
【题目】在有机物分子中,若某个碳原子连接4个不同的原子或原子团,则这种碳原子称为“手性碳原子”。凡有一个手性碳原子的物质一定具有光学活性。物质:  ,具有光学活性,它发生下列反应后生成的有机物没有光学活性的是( )
,具有光学活性,它发生下列反应后生成的有机物没有光学活性的是( )
A.与NaOH溶液共热
B.与甲酸发生酯化反应
C.与银氨溶液发生银镜反应
D.在Ni催化下与H2加成
科目:高中化学 来源: 题型:
【题目】设NA 为阿伏加德罗常数的值。下列说法正确的是
A.8.7gMnO2与40mL 10mol/L的浓盐酸充分反应,生成的氯气分子数为0.1NA
B.0.1molMg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA
C.由2H和18O所组成的水11g,其中所含的中子数为5NA
D.1L0.1mol·L-1Na2CO3溶液中含有的阴离子数为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列比较中正确的是 ( )
A. 碱性:KOH> Mg(OH)2>NaOH
B. 酸性:H3PO4>H2SO4>HClO4
C. 原子半径:K>Na>Mg
D. 氢化物稳定性:NH3>H2O>HF
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粗盐的提纯实验中,下列操作错误的是( )
A.蒸发过程中用玻璃棒不断搅拌
B.先用酒精灯加热蒸发皿,再将滤液倒入蒸发皿中
C.当加热至蒸发皿中有较多固体析出时停止加热,利用余热将液体蒸干
D.蒸发完成时,用坩埚钳把蒸发皿移至石棉网上
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是结构最为简单的饱和一元醇,又称“木醇”或“木精”。甲醇是一碳化学基础的原料和优质的燃料,主要应用于精细化工、塑料、能源等领域。已知甲醇制备的有关化学反应如下:
反应①:CO(g)+2H2(g) ![]() CH3OH(g) △H1=-90.77kJ/mol
CH3OH(g) △H1=-90.77kJ/mol
反应②:CO2(g)+H2(g) ![]() CO(g)+H2O(g) △H2
CO(g)+H2O(g) △H2
反应③:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H3=-49.58kJ/mol
CH3OH(g)+H2O(g) △H3=-49.58kJ/mol
(1)反应②的△H2=__________________
(2)若500℃时三个反应的平衡常数依次为K1、K2与K3,已知500℃时K1、K2的值分别为2.5、1.0,并测得该温度下反应③在某时刻,H2(g)、CO2(g)、CH3OH(g)、H2O(g)的浓度(mol/L)分别为0.8、0.1、0.3、0.15,则此时V正________V逆(填“>”、“=”或“<”)
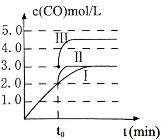
(3)在3L容积可变的密闭容器中发生反应②,c(CO)随反应时间t变化如图中曲线I所示。若在t0时刻分别改变一个条件,曲线I变为曲线II和曲线III。当曲线I变为曲线II时,改变的条件是 。当通过改变压强使曲线I变为曲线III时,曲线III达到平衡时容器的体积为_____________。
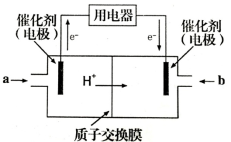
(4)甲醇燃料电池可能成为未来便携电子产品应用的主流。某种甲醇燃料电池工作原理如图所示,则通入a气体的电极电极反应式为 。
(5)一定条件下甲醇与一氧化碳反应可以合成乙酸。常温条件下,将a mol/L的CH3COOH与b mol/LBa(OH)2溶液等体积混合,反应平衡时,2c(Ba2+)=c(CH3COO-),用含a和b的代数式表示该混合溶液中醋酸的电离常数为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年来,科学家、合成了一系列具有独特化学性质的氢铝化合物(AlH3)n,常用作还原剂。已知,最简单的氢铝化合物的化学式为Al2H6,它的熔点为150℃且熔融状态不能导电,燃烧时放出大量的热量。Al2H6的球棍模型如下图所示。下列说法正确的是
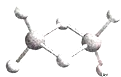
A.Al2H6中Al为-3价,H为+1价
B.Al2H6中含有离子键和极性共价键
C.Al2H6为离子化合物
D.Al2H6在空气中完全燃烧,产物为氧化铝和水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】决定物质性质的重要因素是物质结构。请回答下列问题。
(1)已知A和B为第三周期元素,其原子的第一至第四电离能如下表所示:
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
A | 578 | 1817 | 2745 | 11578 |
B | 738 | 1451 | 7733 | 10540 |
A通常显 价,B元素的核外电子排布式为 。
(2)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如下图所示),已知3种离子晶体的晶格能数据如下表:

离子晶体 | NaCl | KCl | CaO |
晶格能/kJ·mol-1 | 786 | 715 | 3401 |
则该4种离子晶体(不包括NaCl)熔点从高到低的顺序是 。其中MgO晶体中一个Mg2+周围和它最邻近且等距离的Mg2+有 个。
(3)金属阳离子含未成对电子越多,则磁性越大,磁记录性能越好。离子型氧化物V2O5和CrO2中,适合作录音带磁粉原料的是 。
(4)某配合物的分子结构如下图所示,其分子内不含有 (填序号)。

A.离子键
B.极性键
C.金属键
D.配位键
E.氢键
F.非极性键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com