
【题目】喷泉是一种常见的现象,其产生原因是存在压强差。下面是某同学设计的四个不同的喷泉装置,则以下说法不正确的是
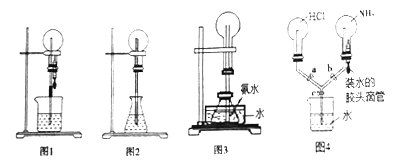
A. 若向图1烧瓶中充满HI(与HCl水溶性相似)气体,烧杯中加入AgNO3溶液,则可以产生黄色喷泉
B. 若向图2锥形瓶中加水,烧瓶中充满SO2,引发喷泉的操作是捂热上方的圆底烧瓶
C. 若向图3装置的水槽中加入冰块或慢慢滴入浓硫酸都可以形成喷泉
D. 图4所示的装置,若要在该装置中产生双喷现象,其操作方法可以是关闭活塞c,打开活塞a、b,再挤压胶头滴管,当产生大量的白烟,再打开活塞c
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质,按混合物、化合物、单质顺序排列的是( )
A. 碘酒、烧碱、液态氧B. 熟石灰、生石灰、白磷
C. 氯化氢、干冰、铁D. 胆矾、酒精、氮气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A(g)+B(g)C(g)+D(g)过程中的能量变化如图所示,下列说法正确的是( ) 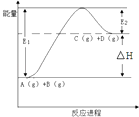
A.该反应是放热反应
B.加入催化剂后,反应加快,△H减小
C.反应物的总键能小于生成物的总键能
D.反应达到平衡时,升高温度,A的转化率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题.硫、氮氧化物是形成酸雨、雾霾等环境污染的罪魁祸首,采用合适的措施消除其污染是保护环境的重要措施.
(1)Ⅰ.研究发现利用NH3可消除硝酸工业尾气中的NO污染.NH3与NO的物质的量之比分别为1:3、3:l、4:1时,NO脱除率随温度变化的曲线如图2所示.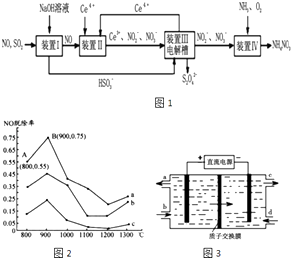
①曲线a中,NO的起始浓度为6×10﹣4mg/m3 , 从A点到B点经过0.8s,该时间段内NO的脱除速率为mg/(m3s).
②曲线b对应的NH3与NO的物质的量之比是 , 其理由是
③已知在25℃,101kPa时:
N2(g)+3H2(g)═2NH3(g)△H=﹣Q1/mol
2H2(g)+O2(g)═2H2O(1)△H=﹣Q2kJ/mo1
N2(g)+O2(g)═2NO(g)△H=+Q3kJ/mo1;
请写出用NH3脱除NO的热化学方程式 .
(2)Ⅱ.工业上还可以变“废”为“宝”,将雾霾里含有的SO2、NO等污染物转化为Na2S2O4(保险粉)和NH4NO3等化工用品,其生产流程如图1:①装置Ⅱ中NO转变为NO3﹣的反应的离子方程式为 .
②装置Ⅲ制得Na2S2O4的同时还能让Ce4+再生,原理如图3所示.其阴极的电极反应式为: .
③按上述流程处理含有amolSO2、bmolNO的雾霾(b>a),并制取Na2S2O4和NH4NO3 . 装置Ⅰ中SO2、装置Ⅱ中NO、装置Ⅲ中HSO3﹣和Ce3+、装置Ⅳ中NO2﹣全部转化,处理完毕后装置Ⅱ中Ce4+的剩余量与加入量相比没有变化,则至少需向装置Ⅳ中通入标准状况下的O2L(用含a、b的代数式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学学习小组在帮助老师整理实验室的化学试剂时,发现一瓶无色溶液,标签破损如下图,据老师回忆,该药品应该是中学化学常用试剂。该小组同学根据已掌握的知识,对溶液进行鉴定。下列说法错误的是
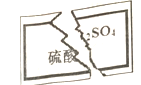
A. 该小组同学推测它的阳离子可能是H+、Na+、K+、NH4+中的某一个
B. 若要证明阳离子是否为NH4+,其方法是: 取少量溶液于试管中加稀NaOH溶液,若产生能使湿润的红色石蕊试纸变蓝的气体,则阳离子为NH4+
C. 某同学操作时不慎将一滴溶液滴落在纸上,纸变黑,说明该溶液为浓硫酸
D. 验证阳离子是否为Na+或者K+的实验方法是焰色反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非金属虽然种类虽然不多,但是与人类的关系密切,回忆几种常见非金属一硅、氯、硫、氮及其化合物的重要性质,回答下列问题:
(1)在无机非金属材料中,硅一直扮演着主要的角色,有下列物品或设备:①陶瓷餐具②砖瓦③水泥路桥④门窗玻璃⑤水晶镜片⑥人工制造的分子筛⑦玛瑙手镯⑧硅太阳能电池⑨石英光导纤维⑩计算机芯片。所用材料为SiO2或要用到SiO2的是_______。
A.④⑤⑦⑧⑨ B.④⑤⑦⑨ C.④⑤⑦⑨ D.①④⑤⑦⑨⑩
(2)1774年,瑞典化学家舍勒在研究软锰矿的过程中发现了氯气。现为了进行有关氯气的性质实验,需要4瓶容积为50mL的氯气(室温下,氯气的密度约为2.9g/L),则用舍勒的方法制取3瓶氯气理论上需要MnO2固体的质量是_____g(保留到小数点后一位,浓盐酸过量,可以补充);实际称量的MnO2固体的质量必须多于理论量,其原因是_____,由于氯气有毒,拆除装置时需要对反应装置内氯气进行处理,以下最理想的吸收剂是_____
A.NaOH溶液 B.浓氨水 C.澄清石灰水 D.水
(3)硫酸和硝酸都是重要的化工原料,在工业上可以用于制化肥、农药、炸药、盐类等。
①现以洗净的废铜屑和浓硝酸为原料,制取硝酸铜,请设计一个既能节约原料又能防止污染环境的方法(用化学方程式表示)____________。
②下列现象中硫酸所表现出的性质中含有强氧化性的是________。
A.把锌粒放入稀硫酸中时,有气体放出
B.盛有浓硫酸的烧杯敞口放置一段时间后,质量增加
C.把浓硫酸倒入润湿的蔗糖中,蔗糖变黑,且有刺激性气味气体生成
D.把木炭放入热的浓硫酸中时,有气体放出
E.在常温下可以用铁、铝制容器盛装冷的浓硫酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学反应2A(g)B(g)+D(g)在四种不同条件下进行,B、D起始浓度为零,反应物A的浓度(mol/L)随反应时间(min)的变化情况如下表:
实验 | 时间 | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800℃ | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800℃ | c2 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 800℃ | c3 | 0.92 | 0.75 | 0.63 | 0.60 | 0.60 | 0.60 |
4 | 820℃ | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
根据上述数据,完成下列填空:
(1)在实验1,反应在10至20分钟时间内平均速率为mol/(Lmin).
(2)在实验2,A的初始浓度c2=mol/L,推测实验2中还隐含的条件是 .
(3)设实验3的反应速率为v3 , 实验1的反应速率为v1 , 则v3v1(填>、<、=),且c31.0mol/L(填>、<、=)
(4)比较实验4和实验1,可推测该反应是反应(选填“吸热”、“放热”).理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理、现象、结论等均正确的是( ) 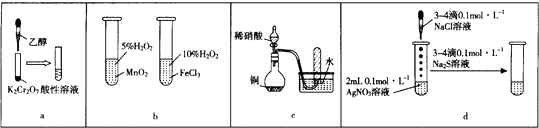
A.a图示装置,滴加乙醇试管中橙色溶液变为绿色,乙醇发生消去反应生成乙酸
B.b图示装置,右边试管中产生气泡迅速,说明氯化铁的催化效果比二氧化锰好
C.c图示装置,根据试管中收集到无色气体,验证铜与稀硝酸的反应产物是NO
D.d图示装置,试管中先有白色沉淀、后有黑色沉淀,不能验证AgCl的溶解度大于Ag2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是()
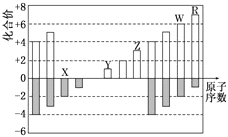
A. 原子半径:Z>Y>X
B. 气态氢化物的稳定性:R
C. WX3和水反应形成的化合物是离子化合物
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com