
【题目】分别称取2.39g(NH4)2SO4和NH4Cl固体混合物两份。
(1)将其中一份配成溶液,逐滴加入一定浓度的Ba(OH)2溶液,产生的沉淀质量与加入Ba(OH)2溶液体积的关系如图。混合物中n[(NH4)2SO4]:n(NH4Cl)为___________。

(2)另一份固体混合物中NH4+与Ba(OH)2溶液(浓度同上)恰好完全反应时,溶液中c(Cl-)=_____(溶液体积变化忽略不计)。
【答案】 1:2 0.1mol/L
【解析】(1)产生的沉淀是硫酸钡,物质的量是2.33g÷233g/mol=0.01mol,根据原子守恒可知硫酸铵的质量是0.01mol×132g/mol=1.32g,则氯化铵的质量是2.39g-1.32g=1.07g,物质的量是1.07g÷53.5g/mol=0.02mol,因此混合物中n[(NH4)2SO4]:n(NH4Cl)为1:2;(2)每一份中硫酸铵和氯化铵分别是0.01mol、0.02mol,另一份固体混合物中NH4+与Ba(OH)2溶液(浓度同上)恰好完全反应时,消耗氢氧化钡是0.02mol,因此溶液体积是200mL,则溶液中c(Cl-)=0.02mol÷0.2L=0.1mol/L。


科目:高中化学 来源: 题型:
【题目】氯化亚铜(CuCl)是微溶于水但不溶于乙醇的白色粉末,溶于浓盐酸会生成HCuCl2,常用作催化剂。一种由海绵铜(Cu和少量CuO等)为原料制备CuCl的工艺流程如下:

(1)“溶解浸取”时,需将海绵铜粉碎成细颗粒,其目的是___________。

(2)“还原,氯化”时,Na2SO3和NaCl的用量对CuCl产率的影响如图所示:
①CuSO4与Na2SO3、NaCl在溶液中反应生成CuCl的离子方程式为___________。
②当n(Na2SO3)/n(CuSO4)>1.33时,比值越大CuCl产率越小,其原因是___________。
③当1.0<n(NaCl)/n(CuSO4)<1.5时,比值越大CuCl产率越大,其原因是___________。
(3)“粗产品”用pH=2的H2SO4水洗,若不慎用稀硝酸进行稀释,则对产品有何影响___________。
(4)用“醇洗”可快速去除滤渣表面的水,防止滤渣被空气氧化为Cu2(OH)3Cl。CuCl被氧化为Cu2(OH)3Cl的化学方程式为______________________。
(5)某同学拟测定产品中氯化亚铜的质量分数。实验过程如下:准确称取制备的氯化亚铜产品1.600g,将其置于足量的FeCl3溶液中,待样品全部溶解后,加入适量稀硫酸,用0.2000mol·L-1的KMnO4标准溶液滴定到终点,消耗KMnO4溶液15.00mL,反应中MnO4-被还原为Mn2+,则产品中氯化亚铜的质量分数为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中硫酸只表现出氧化性的是
A.实验室用浓硫酸干燥氯气、氯化氢等气体
B.将单质碳与浓硫酸混合加热、有刺激性气味气体产生
C.浓硫酸与铜反应,会生成硫酸铜
D.用浓硫酸在木制品上“烙”字画
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应:2A(g)![]() B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
B(g)+D(g)在3种不同条件下进行,B和D的起始浓度均为0,反应物A的浓度随反应时间的变化情况如下表:
实验 序号 | 时间/min 浓度/molL-1 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 | 0.50 |
2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 | 0.50 |
3 | 950 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 | 0.20 |
(1)实验1中,在10~20 min内,以物质A表示的平均反应速率为____mol·L-1·min-l,50 min时,v(正)____(填“<”“>”或“=”)v(逆)。
(2)0~20 min内,实验2比实验1的反应速率_____(填“快”或“慢”),其原因可能是______。
(3)实验3比实验1的反应速率____(填“快”或“慢”),其原因是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某研究性学习小组设计的对一种废旧合金各成分(含有Cu、Fe、Si三种成分)进行分离、回收再利用的工业流程,通过该流程能得到常用的单质、聚铁(碱式硫酸铁的聚合物)、铁红(Fe2O3)和绿矾(FeSO4·7H2O)。
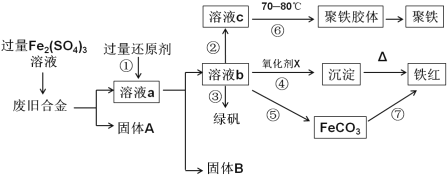
(1)①中过量的还原剂应是____________________。
(2) 向溶液b中加入酸性KMnO4溶液发生反应的离子方程式为_______________________。
(3)②中加入H2O2,并调节pH值得到溶液c,在⑥中,将溶液c控制到70-80℃的目的是________。
(4)在③中,蒸发浓缩需要的硅酸盐仪器除酒精灯外,还有_________________________。
(5)在④中的氧化剂X是________________________。
(6)在⑤中,向溶液b加入了NH4HCO3溶液,得到FeCO3沉淀,写出离子反应方程式 ______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为氢气燃烧的实验。发现烧杯中酸性KMnO4溶液褪色,若将烧杯中的溶液换成含有少量KSCN的FeSO4溶液,溶液呈红色。下列说法不正确的是

A. 将烧杯中溶液换成氢硫酸溶液,溶液无明显变化
B. 与酸性FeSO4溶液发生反应的离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O
C. 该条件下H2燃烧生成了既具有氧化性又具有还原性的物质
D. 该条件下H2燃烧的产物中可能含有一定量的H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、I、W、Q在元素周期表中的相对位罝如下图所示,五种元素中有且只有一种金属元素。下列说法不正确的是

A. X与Y或W与Y所形成的化合物可能会引起相同的环境污染
B. 简单离子半径的大小:X>Y>Z>W>Q
C. Z的氢化物具有较强的还原性
D. 最高价含氧酸酸性:Q>W
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com