
 某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“?”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )
某同学在研究前18号元素时发现,可以将它们排成如图所示的“蜗牛”形状,图中每个“?”代表一种元素,其中O点代表氢元素.下列说法中错误的是( )| A、离O点越远的元素原子半径越大 |
| B、虚线相连的元素处于同一族,A元素位于元素周期表ⅥA族 |
| C、B元素是图中金属性最强的元素 |
| D、B、C最高价氧化物的水化物可以相互反应 |


 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
| A、Na2S溶液中滴入酚酞呈现红色:S2-+2H2O?H2S+2OH- | ||||
B、用铜为电极电解饱和食盐水:2Cl-+2H2O
| ||||
| C、醋酸溶解含碳酸钙的水垢:CaCO3+2H+═Ca2++H2O+CO2↑ | ||||
| D、小苏打溶液中加少量Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、电源左极为正极 |
| B、电解槽左侧的电极反应方程式为:2H2O-4e-═O2+4H+ |
| C、D口导出的溶液为KOH溶液,且浓度比刚加入电解槽右侧时的浓度大 |
| D、在标准状况下,若1min后从C口处收集到的气体比B口处收集到的气体多2.24L,则有0.1NA个SO42-通过阴离子膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、液化石油气的主要成分是甲烷 |
| B、不锈钢餐具和目前流通的硬币都属于合金 |
| C、医院给病人做X光透视时,常给病人服用“钡餐”,其主要成分是碳酸钡 |
| D、制作航天服的聚酯纤维和用于通讯光缆的光导纤维都是新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝粉投入到NaOH溶液中:2Al+2OH-=2AlO2-+H2↑ |
| B、Al(OH)3溶于NaOH溶液中:Al(OH)3+OH-=AlO2-+2H2O |
| C、Ca(OH)2溶液中通入足量的CO2:CO2+OH-=HCO3- |
| D、Al2O3粉末溶于NaOH溶液中:Al2O3+2OH-=2AlO2-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、强碱性溶液中:K+,ClO-,Ba2+,Cl- |
| B、水电离c(H+)═10-12mol?L-1的溶液中:Cl-,CO32-,NO3-,NH4+ |
| C、使甲基橙变红的溶液中:Fe2+,MnO4-,NO3-,Na+ |
| D、中性溶液中:Al3+,NO3-,Cl-,S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、铁电极发生的电极反应式为:Fe-2e-=Fe2+ |
| B、通入甲烷的电极反应式为:CH4+4CO32--8e-=5CO2+2H2O |
| C、为增强污水的导电能力,可向污水中加入适量工业用食盐 |
| D、若左池石墨电极产生44.8L(标况)气体,则消耗0.5 mol氧气 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个的关键步骤.
工业制硫酸时,利用催化氧化反应将SO2转化为SO3是一个的关键步骤.| 1 |
| 2 |

查看答案和解析>>
科目:高中化学 来源: 题型:
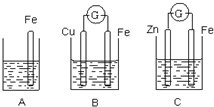 A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.
A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com