
【题目】下列说法正确的是 ( )
A.含有羟基的化合物一定属于醇类
B.代表醇类的官能团是与烃基或苯环侧链上的碳原子相连的羟基
C.酚类和醇类具有相同的官能团,因而具有相同的化学性质
D.分子内有苯环和羟基的化合物一定是酚类
科目:高中化学 来源: 题型:
【题目】硫酰氯(SO2Cl2)常作氯化剂或氯磺化剂,用于制作药品、染料、表面活性剂等。其部分性质如下表:
物质 | 熔点/℃ | 沸点/℃ | 其它性质 |
SO2Cl2 | -54.1 | 69.1 | ①易水解产生大量白雾 ②易分解:SO2Cl2 |
回答下列问题:
I.已知:SO2(g)+Cl2(g) ![]() SO2Cl2(l) ΔH = 97.3 kJ·mol-1。催化合成硫酰氯的实验装置如下图 (夹持仪器已省略):
SO2Cl2(l) ΔH = 97.3 kJ·mol-1。催化合成硫酰氯的实验装置如下图 (夹持仪器已省略):

(1)仪器B的名称是____________,冷却水的进口为________(填“a”或“b”)。
(2)装置D除干燥气体外,另一作用是______________________。若缺少D,则硫酰氯会水解,该反应的化学方程式为_________________________________________。
(3)实验室用二氧化锰和浓盐酸反应制取氯气,写出其反应的离子方程式:__________________________________
(4)C处U形管中碱石灰的作用除吸收多余SO2、Cl2,防止污染外;还有_______________________。
II.在氯磺酸中加入四氯化锡加热煮沸,使氯磺酸分解,可用于制取少量硫酰氯。化学方程式为:2ClSO3H![]() H2SO4+SO2Cl2,此法得到的产品中混有硫酸。
H2SO4+SO2Cl2,此法得到的产品中混有硫酸。
(5)①从分解产物中分离出硫酰氯的方法是_____________。
②请设计实验方案检验产品中硫酸的存在(可选试剂:稀盐酸、稀硝酸、BaCl2溶液、蒸馏水、石蕊溶液):取适量产品,充分___________后,加水稀释__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有如图所示的转化关系,水和部分产物已略去。

已知:①X和Z是两种透明、不溶于水的坚硬固体,其中Z无固定熔点,是现代建筑不可缺少的装饰和采光材料;②无色气体A是引起温室效应的主要气体;
③B、D均为难溶于水的白色固体;④高纯度的F是使用最广泛的半导体材料。
据此回答下列问题:
(1)Z的名称是________,工艺师在Z表面刻蚀花纹图案需用的试剂为________(填名称)。
(2)由X、Y制F的化学方程式为________________________,此反应中Y作________剂(填“氧化”或“还原”)。
(3)转化①的化学方程式为________________________;转化②(A少量)的离子方程式为______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,pH均为2的两种一元酸HA和HB各1mL,分别加水稀释,pH随溶液体积的变化曲线如下图所示。下列说法正确的是( )

A.HA的酸性比HB的酸性弱
B.a点溶液的导电性比c点溶液的导电性弱
C.若两溶液无限稀释,则它们的c(H+)相等
D.对a、b两点溶液同时升高温度,则![]() 增大
增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某金属单质跟一定浓度的硝酸反应,假定只产生单一的还原产物,当参加反应的单质与被还原HNO3的物质的量之比为2∶1时,还原产物可能是
A.N2OB.NO
C.NO2D.N2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在工业生产中有广泛的应用。
(1)请写出电解熔融氯化钠的反应方程式______________________________。如图为离子交换膜法电解饱和食盐水的原理示意图,下列说法正确的是________。
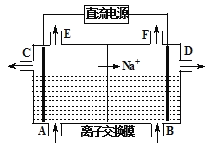
A.直流电源的左侧为负极
B.从E口逸出的气体是H2
C.从B口加入含少量NaOH的水溶液以增强导电性
D.从C口出来的溶液为NaOH溶液
E.每生成22.4 L Cl2,便产生2 mol NaOH
F.粗盐水中含Ca2+、Mg2+、Fe3+、SO42-等离子,精制时先加Na2CO3溶液
G.该离子交换膜为阳离子交换膜
(2)双氧水是一种重要的绿色试剂,工业上可采取电解较稀浓度的硫酸来制取双氧水(H2O2只为还原产物),其电解的化学方程式为3H2O+3O2![]() O3+3H2O2。则阳极的电极反应式为__________________________,阴极的电极反应式____________________。
O3+3H2O2。则阳极的电极反应式为__________________________,阴极的电极反应式____________________。
(3)高铁酸钾(K2FeO4)易溶于水,具有强氧化性,是一种新型水处理剂。工业上用如下方法制备高铁酸钾:以Fe2O3为阳极电解KOH溶液,电解制高铁酸钾时阳极的电极反应式为______________________________。高铁酸钾长期放置会产生红色絮状物及气泡,则该过程的离子方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 | |
(1)称取A 9.0 g,升温使其汽化,测其密度是相同条件下H2的45倍 | A的相对分子质量为________ | |
(2)将此9.0 g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g 和13.2 g | A的分子式为__________ | |
(3)另取A 9.0 g,跟足量的NaHCO3粉末反应,生成2.24 L CO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况) | 用结构简式表示A中含有的官能团:________、________ | |
(4)A的1H核磁共振谱如图: | A中含有______种氢原子 | |
(5)综上所述,A的结构简式为__________其中手性碳原子______个 | ||
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同碳原子数的烷烃、烯烃、炔烃,在空气中完全燃烧生成二氧化碳和水,所需空气量的比较中正确的是 ( )
A.烷烃最少B.烯烃最少
C.炔烃最少D.三者一样多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能够充分说明在恒温下的密闭容器中,反应2SO2+O2![]() 2SO3已达平衡状态的标志是
2SO3已达平衡状态的标志是
A. 容器中SO2.O2.SO3的物质的量之比为2:1:2
B. SO2 和SO3的物质的量浓度相等
C. 单位时间内生成2molSO3 时,即消耗1molO2
D. 反应容器内压强不随时间变化而变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com