
【题目】根据反应2CrO42-+2H+![]() Cr2O72-+H2O 用惰性电极电解Na2CrO4溶液制取Na2Cr2O7,下列说法不正确的是
Cr2O72-+H2O 用惰性电极电解Na2CrO4溶液制取Na2Cr2O7,下列说法不正确的是

A. a连接电源负极
B. b极反应式:2H2O-4e-=O2↑+4H+
C. c为阳离子交换膜
D. 通过2 mol电子时生成1 mol Cr2O72-
【答案】D
【解析】A.右池CrO42-转化为Cr2O72-,应增加H+浓度,b电极上OH-失电子发生氧化,促进水的电离,则b为阳极,a电极为阴极,连接电源负极,故A正确;B.b极阳极上发生氧化反应,其反应式:2H2O-4e-=O2↑+4H+,故B正确;C.与a相连的电极为阴极,阴极上氢离子失电子生成氢气,同时生成氢氧根离子,则电解后溶液中氢氧根离子浓度增大,溶液电荷不守恒,右侧溶液中Na+通过离子交换膜进入左池,则c为阳离子交换膜,故C正确;D.通过2 mol电子时右侧电极生成2molH+,促进2CrO42-+2H+![]() Cr2O72-+H2O平衡右移,根据勒夏特列原理生成Cr2O72-的物质的量小于1 mol ,故D错误;答案为D。
Cr2O72-+H2O平衡右移,根据勒夏特列原理生成Cr2O72-的物质的量小于1 mol ,故D错误;答案为D。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】下列各组物质融化或升华时,所克服的粒子间作用力属于同种类型的是
A.Na2O2和SiO2融化 B.Mg和S融化 C.氯化钠和蔗糖融化 D.碘和干冰升华
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器内充入4 mol S02和3mol 02,在一定条件下建立平衡:
2SO2(g)+02(g)![]() 2SO3(g) △H="-Q" kJ·mol-1(Q>0),测得SO2的转化率为90%,
2SO3(g) △H="-Q" kJ·mol-1(Q>0),测得SO2的转化率为90%,
则在此条件下反应放出的热量为( )
A. 1.8Q kJ B. 2Q kJ C. Q kJ D. 0.9 QJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】采用电解法还原CO2是CO2资源化的一种方法。某学习小组设计了一套以CO2为原料制备ZnC2O4的装置,其反应原理示意图如下(电解液不参与电极反应)。下列说法正确的是

A. 电源的正极应与Pb电极连接
B. 电解时Zn2+可通过阳离子交换膜进入左侧
C. 电解时,阴极反应为:Zn-2e-═Zn2+
D. 标况下,消耗CO2气体4.48L时,交换膜右侧电解液质量减轻6.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应N2+3H2![]() 2NH3是工业上合成氨的重要反应。
2NH3是工业上合成氨的重要反应。

(1)根据图1请写出合成氨的热化学方程式_________________(热量用E1、E2或E3表示)。
(2)图1中虚线部分是通过改变化学反应中的________条件,该条件的改变与图2中哪一时刻条件的改变相同___________(用“t1……t6”表示)。
(3)t3时刻改变的条件是___________,t5时刻改变的条件是___________。
(4)某温度下,若把10 mol N2与30 molH2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为20%,则氮气的转化率____________。
(5)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 molN2和3 molH2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1kJ;B中NH3的体积分数为b,放出热量Q2kJ。则:a__________b (填“>”、“<”或“=”,下同),Q1___________Q2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一小块钠投入到FeCl3溶液中,观察到的现象是( )
A. 钠溶解,有铁析出并有气体产生
B. 只有气体产生
C. 既有气体产生,又有红褐色沉淀产生
D. 只有沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某溶液中加入含Fe2+的溶液后,无明显变化。当再滴入新制氯水后,混合溶液变成红色,则下列结论错误的是( )
A. 该溶液中一定含有SCN- B. 氧化性:Fe3+>Cl2
C. Fe2+与SCN-不能形成红色物质 D. Fe2+被氧化为Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示装置中,甲、乙、丙三个烧杯依次分别盛放足量的KI溶液、足量的CuSO4溶液和K2SO4溶液,电极均为石墨电极。接通电源,经过一段时间后,测得乙中c电极质量增加32 g。据此回答问题: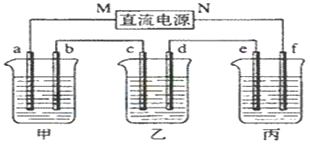
(1) 电源的N端为_________极;
(2) 电极b上发生的电极反应为____________________________________________;
(3) 电极f上生成的气体在标准状况下的体积_________________________________;
(4) 电解开始时,在甲烧杯的中央,滴几滴淀粉溶液,你能观察到的现象是______________;
(5) 电解前后溶液的pH变化情况,(填增大、减小或不变)甲溶液___________;乙溶液_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①Zn(s)+![]() O2(g)=ZnO(s)ΔH=-348.3kJ·mol-1
O2(g)=ZnO(s)ΔH=-348.3kJ·mol-1
②2Ag(s)+![]() O2(g)=Ag2O(s)ΔH=-31.0kJ·mol-1
O2(g)=Ag2O(s)ΔH=-31.0kJ·mol-1
则Zn与Ag2O反应生成ZnO和Ag的热化学方程式为
A. Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)ΔH=+317.3kJ·mol-1
B. Zn+Ag2O===ZnO+2Ag ΔH=+317.3kJ·mol-1
C. Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)ΔH=-317.3kJ
D. 2Zn(s)+2Ag2O(s)===2ZnO(s)+4Ag(s)ΔH=-634.6 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com