
【题目】金属和合金是生活中常用的材料。下列说法正确的是
A.不锈钢是铁合金,只含金属元素
B.镧镍(La-Ni)合金能大量吸收H2形成金属氢化物,可作储氢材料
C.目前世界上使用量最大的合金是铝合金
D.常温下,铁粉可以和水发生置换反应得到氢气
科目:高中化学 来源: 题型:
【题目】图甲是H2O2酶活性受pH影响的曲线,图乙表示在最适温度下、pH=b时H2O2分解产生的O2量随时间的变化.若该酶促反应过程中改变某一初始条件,以下改变正确的是( )
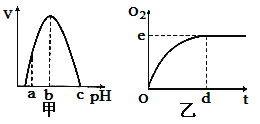
A.pH=a时,e点下移,d点左移
B.H2O2酶量增加时,e点上移,d点左移
C.H2O2量增加时,e点不移,d点左移
D.温度升高时,e点不移,d点右移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)下列各选项有关对应有机物的说法正确的是( )
A |
| 最多有18个原子处在同一平面上 |
B |
| 主链上的碳原子数是5 |
C |
| 加氢后可以得到3-甲基戊烷 |
D |
| 的名称是1,3, 4-三甲基苯 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是
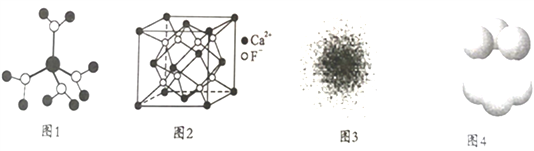
A. 水合铜离子的模型如图1所示,1个水合铜离子中有4个配位键
B. CaF2晶体的晶胞如图2所示,每个CaF2晶胞平均占有4个Ca2+
C. 氢原子的电子云图如图3所示,氢原子核外的大多数电子在原子核附近运动
D. 金属Cu中铜原子堆积模型如图4所示,该金属晶体为最密堆积,每个铜原子的配位数均为12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列模型并结合有关信息进行判断,下列说法错误的是( )
HCN | S8 | SF6 | B12结构单元 | |
结构模 型示意 图 |
|
|
|
|
备注 | / | 易溶于CS2 | / | B的熔点为1873K |
A.HCN的结构式为H—C≡N
B.固态S8属于原子晶体
C.SF6是由极性键构成的非极性分子
D.单质硼属于原子晶体,其结构单元中含有30个B—B键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钕铁硼永磁合金因其具有优异的磁性能而被称为“磁王”,钕铁硼永磁合金中含有铁、硼及大量的稀土元素钕。
(1)基态铁原子的价层电子排布图为___________________,铁元素所在周期第一电离能最大的主族元素是________(填元素符号);已知基态钕(Nd)原子的价层电子排布式为4f46s2,则基态钕原子核外共有__________种类型的能级分布。
(2)硼与氢能形成类似于烃的一系列分子,如B2H6、B3H9、B4H10等。
①B2H6、B3H9、B4H10三种物质的沸点由低到高的顺序为__________________________;
②乙硼烷的结构式可表示为(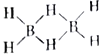 )已知反应B2H6+3O2
)已知反应B2H6+3O2![]() B2O3+2H2O中被氧化的元素是氢元系,则H、B、O三种元素电负性由大到小的顺序为___________________;B2H6分子中有4个σ键、2个相同的大π键(多原子间共用多个电子形成的一种共价键),则构成一个大π键的原子、电子数目分别为__________________________。
B2O3+2H2O中被氧化的元素是氢元系,则H、B、O三种元素电负性由大到小的顺序为___________________;B2H6分子中有4个σ键、2个相同的大π键(多原子间共用多个电子形成的一种共价键),则构成一个大π键的原子、电子数目分别为__________________________。
(3)硼酸分子中含有三个“-OH”,易溶于水,其易溶于水的主要原因是_________________。
(4)图1是三氧化二硼的一种球根模型图, 则硼原子、氧原子的杂化轨道类型分别为_____________。
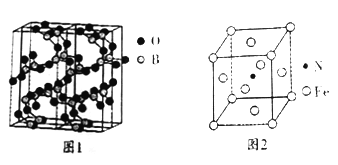
(5)铁元素与氮元素也能形成种磁性材料,其晶胞如图2所示,该磁性材料的化学式为__________;若该晶体的密度为p,铁原子、氮原子的半径分别为r(Fe)pm,r(N)pm,则该晶胞的空间利用率为_______(设阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组欲探究SO2的化学性质,设计了如下实验方案。
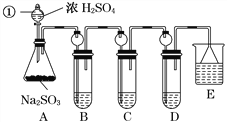
(1)指出仪器①的名称:______________。
(2)检查A装置的气密性的方法是______________________________________________。
(3)装置B检验SO2的氧化性,则B中所盛试剂可以为________。
(4)装置C中盛装溴水用以检验SO2的________性,则C中反应的离子方程式为
________________________________________________________________________。
(5)装置D中盛装新制漂白粉浓溶液,通入SO2一段时间后,D中出现了大量白色沉淀。同学们对白色沉淀成分提出三种假设:
①假设一:该白色沉淀为CaSO3;
假设二:该白色沉淀为__________________________________________________;
假设三:该白色沉淀为上述两种物质的混合物。
②基于假设一,同学们对白色沉淀成分进行了探究。设计如下方案:
限选的仪器和试剂:过滤装置、试管、滴管、带导管的单孔塞、蒸馏水、0.5 mol·L-1HCl、0.5 mol·L-1H2SO4、0.5 mol·L-1BaCl2、1 mol·L-1NaOH、品红溶液。
第1步,将D中沉淀过滤、洗涤干净,备用。
请回答洗涤沉淀的方法:____________________________________________________。
第2步,用另一只干净试管取少量沉淀样品,加入________(试剂),塞上带导管的单孔塞,将导管的另一端插入盛有________(试剂)的试管中。若出现__________________现象,则假设一成立。
③若假设二成立,试写出生成该白色沉淀的化学方程式:_________________________________。
(6)装置E中盛放的试剂是________,作用是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(6分)将4molSO2与2molO2放入4L的密闭容器中,在一定条件下反应达到平衡:2SO2(g)+O2(g)![]() 2SO3(g) ,测得平衡时混合物总的物质的量为5mol,求:
2SO3(g) ,测得平衡时混合物总的物质的量为5mol,求:
(1)平衡时SO3的浓度;
(2)该温度下的平衡常数;
(3)平衡时SO2的转化率。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com