
【题目】钕铁硼永磁合金因其具有优异的磁性能而被称为“磁王”,钕铁硼永磁合金中含有铁、硼及大量的稀土元素钕。
(1)基态铁原子的价层电子排布图为___________________,铁元素所在周期第一电离能最大的主族元素是________(填元素符号);已知基态钕(Nd)原子的价层电子排布式为4f46s2,则基态钕原子核外共有__________种类型的能级分布。
(2)硼与氢能形成类似于烃的一系列分子,如B2H6、B3H9、B4H10等。
①B2H6、B3H9、B4H10三种物质的沸点由低到高的顺序为__________________________;
②乙硼烷的结构式可表示为(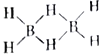 )已知反应B2H6+3O2
)已知反应B2H6+3O2![]() B2O3+2H2O中被氧化的元素是氢元系,则H、B、O三种元素电负性由大到小的顺序为___________________;B2H6分子中有4个σ键、2个相同的大π键(多原子间共用多个电子形成的一种共价键),则构成一个大π键的原子、电子数目分别为__________________________。
B2O3+2H2O中被氧化的元素是氢元系,则H、B、O三种元素电负性由大到小的顺序为___________________;B2H6分子中有4个σ键、2个相同的大π键(多原子间共用多个电子形成的一种共价键),则构成一个大π键的原子、电子数目分别为__________________________。
(3)硼酸分子中含有三个“-OH”,易溶于水,其易溶于水的主要原因是_________________。
(4)图1是三氧化二硼的一种球根模型图, 则硼原子、氧原子的杂化轨道类型分别为_____________。
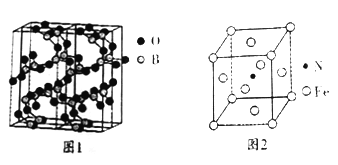
(5)铁元素与氮元素也能形成种磁性材料,其晶胞如图2所示,该磁性材料的化学式为__________;若该晶体的密度为p,铁原子、氮原子的半径分别为r(Fe)pm,r(N)pm,则该晶胞的空间利用率为_______(设阿伏加德罗常数的值为NA)。
【答案】 ![]() Br 4 B2H6<B3H9<B4H10 O>H>B 硼酸分子能与水分子间形成氢键 sp2 sp3 Fe4N
Br 4 B2H6<B3H9<B4H10 O>H>B 硼酸分子能与水分子间形成氢键 sp2 sp3 Fe4N ![]()
【解析】分析:(1)根据铁的价电子层为3d64s2,由泡利原理和洪特规则确定价层电子排布图;在同一周期中自左向右第一电离能有增大的趋势,Br在第四周期主族元素最右面,由此可确定;基态钕原子核外有s、p、d、f共4种类型的能级分布。(2)①分子晶体,相对分子质量越大,分子间作用力越大,沸点越高;②非金属性越强电负性越大;(3)氢键影响物质的溶解性;以此分析;(4)通过分析成键电子对和孤电子对数来确定杂化类型;(5)利用均摊法确定化学式,利用密度,求出一个晶胞的体积,一个晶胞中含有的所有原子体积之和与一个晶胞体积的百分比就是该晶胞的空间利用率。
详解:(1)铁的原子序数为26,价电子数为26-18=8,所以价电子层为3d64s2,由泡利原理和洪特规则知,铁原子的价层电子排布图为![]() ;在同一周期中自左向右第一电离能有增大的趋势,铁元素所在周期为第四周期,第一电离能最大的主族元素是Br;基态钕(Nd)原子的价层电子排布式为4f46s2,则基态钕原子核外有s、p、d、f共4种类型的能级分布。因此,本题正确答案为:
;在同一周期中自左向右第一电离能有增大的趋势,铁元素所在周期为第四周期,第一电离能最大的主族元素是Br;基态钕(Nd)原子的价层电子排布式为4f46s2,则基态钕原子核外有s、p、d、f共4种类型的能级分布。因此,本题正确答案为:![]() ; Br; 4
; Br; 4
(2)①B2H6、B3H9、B4H10三种物质均为分子晶体,沸腾时都破坏分子间作用力,相对分子质量Mr(B4H10)>Mr(B3H9)>Mr(B2H6),所以分子间作用力从B2H6到B4H10依次增大,沸点从B2H6到B4H10依次升高,所以B2H6<B3H9<B4H10。
②根据反应B2H6+3O2![]() B2O3+2H2O中被氧化的元素是氢元素,B2H6中B的化合价没变和B2O3中B的化合价相同为+3价,则H的化合价为-1价,从而判断H、B、O三种元素的非金属性O>H>B,非金属性越强电负性越大,所以H、B、O三种元素电负性由大到小的顺序为O>H>B;B2H6共有12个价电子,形成4个σ键用去8个电子,还有4个电子形成2个相同的大π键,则构成一个大π键的原子、电子数目分别为4和2。
B2O3+2H2O中被氧化的元素是氢元素,B2H6中B的化合价没变和B2O3中B的化合价相同为+3价,则H的化合价为-1价,从而判断H、B、O三种元素的非金属性O>H>B,非金属性越强电负性越大,所以H、B、O三种元素电负性由大到小的顺序为O>H>B;B2H6共有12个价电子,形成4个σ键用去8个电子,还有4个电子形成2个相同的大π键,则构成一个大π键的原子、电子数目分别为4和2。
(3)硼酸分子中含有三个“-OH”,容易和水分子形成氢键,所以易溶于水的主要原因是硼酸分子能与水分子间形成氢键。
(4)从图1可知, 硼原子形成3个σ键,无孤对电子,所以为sp2 杂化;氧原子形成2个σ键,有两对孤对电子,所以为sp3 杂化,因此,本题正确答案为:sp2 ; sp3;
(5)从晶胞图知,一个晶胞中含有Fe原子=8![]() +6
+6![]() =4,含有N原子=1(体心),所以该磁性材料的化学式为Fe4N;一个晶胞的质量=
=4,含有N原子=1(体心),所以该磁性材料的化学式为Fe4N;一个晶胞的质量=![]() g=
g=![]() g,根据
g,根据![]() =
=![]() ,得一个晶胞的体积=
,得一个晶胞的体积=![]() =
=![]() ,4个铁原子的体积=4×
,4个铁原子的体积=4×![]() r3(Fe)×10-30cm3、1个氮原子的体积=4×
r3(Fe)×10-30cm3、1个氮原子的体积=4×![]() r3(N)×10-30cm3,,则该晶胞的空间利用率=(4个铁原子的体积+1个氮原子的体积)/一个晶胞的体积×100%=
r3(N)×10-30cm3,,则该晶胞的空间利用率=(4个铁原子的体积+1个氮原子的体积)/一个晶胞的体积×100%=![]() 。
。


科目:高中化学 来源: 题型:
【题目】过氧化钙微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。回答下列问题:
(一)碳酸钙的制备

(1)步骤①加入氨水的目的是_______。小火煮沸的作用是使沉淀颗粒长大,有利于____。
(2)下图是某学生的过滤操作示意图,其操作不规范的是______(填标号)。

a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(二)过氧化钙的制备

(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈____性(填“酸”、“碱”或“中”)。将溶液煮沸,趁热过滤。将溶液煮沸的作用是___________。
(4)步骤③中反应的化学方程式为________,该反应需要在冰浴下进行,原因是_________。
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是_______。
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是______,产品的缺点是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式书写正确的是
A. 硫酸和氢氧化钡溶液混合:H++OH-=H2O
B. 铜与浓硫酸: Cu + 2H+ =Cu2+ + H2↑
C. 银片插入硝酸铜溶液中:Cu2++2Ag = Cu+2Ag+
D. 大理石与稀盐酸反应:CaCO3+2H+=Ca2++CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属和合金是生活中常用的材料。下列说法正确的是
A.不锈钢是铁合金,只含金属元素
B.镧镍(La-Ni)合金能大量吸收H2形成金属氢化物,可作储氢材料
C.目前世界上使用量最大的合金是铝合金
D.常温下,铁粉可以和水发生置换反应得到氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述不正确的是
选项 | 事实 | 原因 |
A | 钠保存在煤油中 | 钠在空气中会发生变化 |
B | 钠露置在空气中,迅速变暗 | 钠与氧气反应生成过氧化钠 |
C | 钠与水反应后滴入酚酞试剂,溶液变红 | 有碱性物质生成 |
D | 钠在加热条件下能与氧气反应生成淡黄色固体 | 钠有还原性 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前20号元素W、X、Y、Z的原子序数依次增大,且分列四个不同周期和四个不同主族。其中A为Y元素组成的单质;甲、乙、丙、丁、戊为上述四种元素组成的二元或三元化合物;常温下乙为液体。下列说法正确的是

A. 简单离子半径:Z>Y
B. 反应①为吸热反应
C. 反应②为工业上制备漂白粉的反应原理
D. X、Y分别与Z形成的化合物中,化学键类型一定相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的分类有多种方法,下列对无机化合物分类如图:

(1)如图所示的物质分类方法的名称是________。
(2)以元素 Na、Ba、H、O、S、N 中任意两种或三种元素组成合适的物质,将化学式分别填在下表中④、⑥的后面________、__________

(3)⑦和⑧的水溶液可导电,它们________(填“是”或“不是”)电解质;相同质量的两气体所含氧原子的个数比为________;标准状况下等体积两气体的质量比为________。
(4)少量⑧与足量④的溶液反应的离子方程式为________。
(5)写出⑦与⑨反应的化学方程式________。
(6)写出工业制造硝酸过程中⑩NH3 与氧气反应的化学方程式为________,若 16g 氧气全部被还原,则转移电子________mol。
(7)现有由①与②混合的稀溶液 100mL,其中①的物质的量浓度为 2.0mol·L-1,②的物质的量浓度为 1.0mol·L-1。则该溶液能溶解铜的最大质量为________g,同时,反应生成的气体在标准状况下的体积为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是实验室的硫酸试剂标签上的部分内容。据此,下列说法正确的是

A. 该硫酸的物质的量浓度为9.2mol·L-1
B. 1mol Fe与足量的稀硫酸反应,标准状况下产生44.8L气体
C. 若实验室需要4.6 mol/L的稀硫酸500mL,配制稀硫酸时则应量取该硫酸125.0mL
D. 该硫酸与等体积的水混合后,所得溶液的质量分数等于49%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com