
【题目】2017年诺贝尔化学奖授予用冷冻电镜测定分子结构的科学家。下列物质由分子构成的是
A.氯化钠B.铜C.水D.金刚石
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案科目:高中化学 来源: 题型:
【题目】(题文)下列各选项有关对应有机物的说法正确的是( )
A |
| 最多有18个原子处在同一平面上 |
B |
| 主链上的碳原子数是5 |
C |
| 加氢后可以得到3-甲基戊烷 |
D |
| 的名称是1,3, 4-三甲基苯 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钕铁硼永磁合金因其具有优异的磁性能而被称为“磁王”,钕铁硼永磁合金中含有铁、硼及大量的稀土元素钕。
(1)基态铁原子的价层电子排布图为___________________,铁元素所在周期第一电离能最大的主族元素是________(填元素符号);已知基态钕(Nd)原子的价层电子排布式为4f46s2,则基态钕原子核外共有__________种类型的能级分布。
(2)硼与氢能形成类似于烃的一系列分子,如B2H6、B3H9、B4H10等。
①B2H6、B3H9、B4H10三种物质的沸点由低到高的顺序为__________________________;
②乙硼烷的结构式可表示为(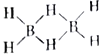 )已知反应B2H6+3O2
)已知反应B2H6+3O2![]() B2O3+2H2O中被氧化的元素是氢元系,则H、B、O三种元素电负性由大到小的顺序为___________________;B2H6分子中有4个σ键、2个相同的大π键(多原子间共用多个电子形成的一种共价键),则构成一个大π键的原子、电子数目分别为__________________________。
B2O3+2H2O中被氧化的元素是氢元系,则H、B、O三种元素电负性由大到小的顺序为___________________;B2H6分子中有4个σ键、2个相同的大π键(多原子间共用多个电子形成的一种共价键),则构成一个大π键的原子、电子数目分别为__________________________。
(3)硼酸分子中含有三个“-OH”,易溶于水,其易溶于水的主要原因是_________________。
(4)图1是三氧化二硼的一种球根模型图, 则硼原子、氧原子的杂化轨道类型分别为_____________。
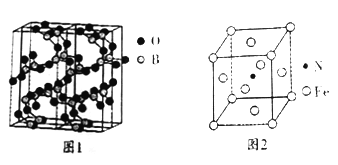
(5)铁元素与氮元素也能形成种磁性材料,其晶胞如图2所示,该磁性材料的化学式为__________;若该晶体的密度为p,铁原子、氮原子的半径分别为r(Fe)pm,r(N)pm,则该晶胞的空间利用率为_______(设阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组欲探究SO2的化学性质,设计了如下实验方案。
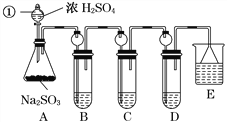
(1)指出仪器①的名称:______________。
(2)检查A装置的气密性的方法是______________________________________________。
(3)装置B检验SO2的氧化性,则B中所盛试剂可以为________。
(4)装置C中盛装溴水用以检验SO2的________性,则C中反应的离子方程式为
________________________________________________________________________。
(5)装置D中盛装新制漂白粉浓溶液,通入SO2一段时间后,D中出现了大量白色沉淀。同学们对白色沉淀成分提出三种假设:
①假设一:该白色沉淀为CaSO3;
假设二:该白色沉淀为__________________________________________________;
假设三:该白色沉淀为上述两种物质的混合物。
②基于假设一,同学们对白色沉淀成分进行了探究。设计如下方案:
限选的仪器和试剂:过滤装置、试管、滴管、带导管的单孔塞、蒸馏水、0.5 mol·L-1HCl、0.5 mol·L-1H2SO4、0.5 mol·L-1BaCl2、1 mol·L-1NaOH、品红溶液。
第1步,将D中沉淀过滤、洗涤干净,备用。
请回答洗涤沉淀的方法:____________________________________________________。
第2步,用另一只干净试管取少量沉淀样品,加入________(试剂),塞上带导管的单孔塞,将导管的另一端插入盛有________(试剂)的试管中。若出现__________________现象,则假设一成立。
③若假设二成立,试写出生成该白色沉淀的化学方程式:_________________________________。
(6)装置E中盛放的试剂是________,作用是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁的化合物溶于盐酸,滴加KSCN溶液不发生颜色变化,再加入适量氯水,溶液立即呈红色的是( )
A. FeO B. FeCl3 C. Fe2(SO4)3 D. Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法中正确的是( )
A. 2.8 g乙烯和丙烯的混合气体中所含碳原子数为0.2 NA
B. 标准状况下,2.24 L CCl4中含有的氯原子数为0.4 NA
C. 1 mol丙烯醛分子中含有的双键数为NA
D. 1 mol CH4含有的电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(6分)将4molSO2与2molO2放入4L的密闭容器中,在一定条件下反应达到平衡:2SO2(g)+O2(g)![]() 2SO3(g) ,测得平衡时混合物总的物质的量为5mol,求:
2SO3(g) ,测得平衡时混合物总的物质的量为5mol,求:
(1)平衡时SO3的浓度;
(2)该温度下的平衡常数;
(3)平衡时SO2的转化率。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家使用普通氧分子和带正电的氧离子可以制造出一种含有四个氧原子的新型氧分子,利用质谱仪探测可以证实它的存在。你认为下列说法正确的是
A.该分子带2个单位正电荷
B.该分子构成的物质与臭氧是同一种物质
C.该分子是一种新的氧化物分子
D.该物质与氧气、臭氧互称为同素异形体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com