
【题目】下列叙述不正确的是
选项 | 事实 | 原因 |
A | 钠保存在煤油中 | 钠在空气中会发生变化 |
B | 钠露置在空气中,迅速变暗 | 钠与氧气反应生成过氧化钠 |
C | 钠与水反应后滴入酚酞试剂,溶液变红 | 有碱性物质生成 |
D | 钠在加热条件下能与氧气反应生成淡黄色固体 | 钠有还原性 |
A. A B. B C. C D. D
 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:
【题目】(2016·天津卷) 下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为__________。
(2)表中元素原子半径最大的是(写元素符号)__________。
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1 mol Y单质比1 mol S得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1 mol X的最高价化合物,恢复至室温,放热687 kJ,已知该化合物的熔、沸点分别为69 ℃和58 ℃,写出该反应的热化学方程式:__________。
(5)碳与镁形成的1 mol化合物Q与水反应,生成2 mol Mg(OH)2和1 mol烃,该烃分子中碳氢质量比为9∶1,烃的电子式为__________。Q与水反应的化学方程式为__________。
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1 L 2.2 mol/L NaOH溶液和1 mol O2,则两种气体的分子式及物质的量分别为__________,生成硫酸铜物质的量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(NH4)2Fe(SO4)2·6H2O(莫尔盐,浅绿色)是重要的化工原料和化学试剂。某课题小组为了探究莫尔盐的分解产物,开展了如下实验:
(1)甲组同学猜想:莫尔盐的分解产物可能是N2、SO3、Fe2O3和H2O四种物质。你是否同意甲组同学的猜想,并说明理由:_________________________________。
(2)乙组同学按照如下图所示的装置进行实验,关闭止水夹,加热A中的莫尔盐固体至分解完全,检验其分解产物。
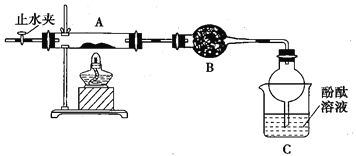
①装置B的仪器名称是____________________,所盛试剂是________________。
②装置C中可观察到的现象是_____________________________________________,由此可知硫酸亚铁铵分解的产物中有______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列模型并结合有关信息进行判断,下列说法错误的是( )
HCN | S8 | SF6 | B12结构单元 | |
结构模 型示意 图 |
|
|
|
|
备注 | / | 易溶于CS2 | / | B的熔点为1873K |
A.HCN的结构式为H—C≡N
B.固态S8属于原子晶体
C.SF6是由极性键构成的非极性分子
D.单质硼属于原子晶体,其结构单元中含有30个B—B键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)是人体健康必需的一种微量元素。已知Se的原子结构示意图为: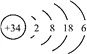 下列说法不正确的是
下列说法不正确的是
A. 该原子的质量数为34 B. 该元素处于第四周期第ⅥA族
C. SeO2既有氧化性又有还原性 D. 酸性:HBrO4 > H2SeO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钕铁硼永磁合金因其具有优异的磁性能而被称为“磁王”,钕铁硼永磁合金中含有铁、硼及大量的稀土元素钕。
(1)基态铁原子的价层电子排布图为___________________,铁元素所在周期第一电离能最大的主族元素是________(填元素符号);已知基态钕(Nd)原子的价层电子排布式为4f46s2,则基态钕原子核外共有__________种类型的能级分布。
(2)硼与氢能形成类似于烃的一系列分子,如B2H6、B3H9、B4H10等。
①B2H6、B3H9、B4H10三种物质的沸点由低到高的顺序为__________________________;
②乙硼烷的结构式可表示为(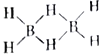 )已知反应B2H6+3O2
)已知反应B2H6+3O2![]() B2O3+2H2O中被氧化的元素是氢元系,则H、B、O三种元素电负性由大到小的顺序为___________________;B2H6分子中有4个σ键、2个相同的大π键(多原子间共用多个电子形成的一种共价键),则构成一个大π键的原子、电子数目分别为__________________________。
B2O3+2H2O中被氧化的元素是氢元系,则H、B、O三种元素电负性由大到小的顺序为___________________;B2H6分子中有4个σ键、2个相同的大π键(多原子间共用多个电子形成的一种共价键),则构成一个大π键的原子、电子数目分别为__________________________。
(3)硼酸分子中含有三个“-OH”,易溶于水,其易溶于水的主要原因是_________________。
(4)图1是三氧化二硼的一种球根模型图, 则硼原子、氧原子的杂化轨道类型分别为_____________。
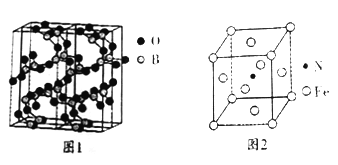
(5)铁元素与氮元素也能形成种磁性材料,其晶胞如图2所示,该磁性材料的化学式为__________;若该晶体的密度为p,铁原子、氮原子的半径分别为r(Fe)pm,r(N)pm,则该晶胞的空间利用率为_______(设阿伏加德罗常数的值为NA)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某氯化镁溶液的密度为 1.16g·cm-3,其中镁离子的质量分数为 4.1%,500mL 该溶液中 Cl-的物质的量浓度约等于( )
A. 4.0mol·L-1B. 2.4mol·L-1C. 2.1mol·L-1D. 1.26mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁的化合物溶于盐酸,滴加KSCN溶液不发生颜色变化,再加入适量氯水,溶液立即呈红色的是( )
A. FeO B. FeCl3 C. Fe2(SO4)3 D. Fe2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或二者混合物。探究过程如下:
查阅资料:Cu2O是一种碱性氧化物, 溶于稀硫酸生成Cu和CuSO4, 在空气中加热生成CuO
提出假设: 假设1:红色粉末是Fe2O3 假设2:红色粉末是Cu2O
假设3:红色粉末是Fe2O3和Cu2O的混合物
设计探究实验: 取少量粉末放入足量稀硫酸中,在所得溶液中再滴加 KSCN试剂。
(1)若假设1成立,则实验现象是_______________。
(2)若滴加 KSCN 试剂后溶液不变红色,则证明原固体粉末中一定不含三氧化二铁。你认为这种说法合理吗?__________简述你的理由(不需写出反应的方程式)____________。
(3)若固体粉末完全溶解无固体存在,滴加KSCN 试剂时溶液不变红色,则证明原固体粉末是__________,写出发生反应的离子方程式______、__________、______________。
探究延伸:
(4)如果经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。某实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量不再变化时,称其质量为bg(b > a),则混合物中Cu2O的质量分数为__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com