
【题目】图甲是H2O2酶活性受pH影响的曲线,图乙表示在最适温度下、pH=b时H2O2分解产生的O2量随时间的变化.若该酶促反应过程中改变某一初始条件,以下改变正确的是( )
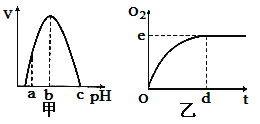
A.pH=a时,e点下移,d点左移
B.H2O2酶量增加时,e点上移,d点左移
C.H2O2量增加时,e点不移,d点左移
D.温度升高时,e点不移,d点右移
科目:高中化学 来源: 题型:
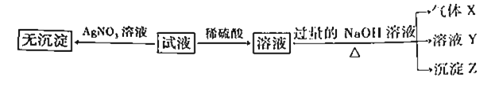
【题目】某试液中只可能含有K+、NH4+、Fe2+、Al3+、Cl﹣、SO42﹣、CO32﹣、AlO2﹣ 中的若干种离子,离子浓度均为 0.1molL﹣1.某同学进行了如下实验:

下列说法正确的是( )
A. 无法确定原试液中是否含有 Al3+、 Cl﹣
B. 滤液 X 中大量存在的阳离子有 NH4+、 Fe2+和 Ba2+
C. 无法确定沉淀 C 的成分
D. 原溶液中存在的离子为 NH4+、 Fe2+、 Cl﹣、 SO42﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用电子式表示下列离子化合物的形成过程:
BaCl2_____________________________;
NaF__________________________________;
MgS________________________________;
K2O_________________________________。
(学法题)请归纳物质电子式的书写及用电子式表示化合物的形成过程应注意哪些问题(至少两点)_______、__________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
Ⅰ.形式一:(由粒子数推断)![]() 、
、![]() 、
、![]() 、D、E 5种粒子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:①
、D、E 5种粒子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:①![]() ;②
;②![]() 。据此,回答下列问题:写出
。据此,回答下列问题:写出![]() 、
、![]() 的化学式:____、______、
的化学式:____、______、
Ⅱ. 形式二:(由元素原子结构推断)A、B、C、D、E、F的原子序数依次增大,它们都是同周期的元素。已知:A、C、F 三种原子最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层电子数少4;E元素原子次外层电子数比最外层电子数多2。
(1)写出下列元素的符号:A________,B________,E________
(2)F在元素周期表中的位置为___________________________________
(3)写出C的单质和A的最高价氧化物的水化物反应的离子方程式_______
(4)元素的非金属性为(原子的得电子能力):E________F(填“强于”或“弱于”),请以E、F为例列举元素非金属性强弱的比较方法__________________________________________________(至少2条)
通过Ⅱ的解题你认为推断出本题各元素的关键环节为___________
III.形式三:(由元素位置推断)下表为元素周期表的一部分:
族 周期 | ||||||||
1 | ① | |||||||
2 | ② | |||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)请画出元素⑦的离子结构示意图________________。
(2)写出元素⑤在周期表中的位置______________。
(3)②、③、⑥的离子半径由大到小的顺序为_________________________。
(4)⑤、⑥、⑦的最高价氧化物对应水化物酸性由强到弱的顺序是______。
(5)①、②、③三种元素可形成既含离子键又含极性共价键的化合物,写出该化合物的电子式:____________________。该化合物与④的最高价氧化物反应的离子方程式为____________________。
(6)请你预测:如果发现了原子序数为116号元素,它在周期表中的位置是第________周期_______族,它属于_____元素(填“金属”或“非金属”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将容积为50mL的量筒内充满NO2和O2的混合气体,倒置量筒在盛满水的水槽里,足够时间后,量筒里剩余气体体积为5mL。则混合气体中NO2和O2体积比可能是( )
A. 13:7B. 15:7
C. 18:7D. 20:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。以下是一种制备过氧化钙的实验方法。回答下列问题:
(一)碳酸钙的制备

(1)步骤①加入氨水的目的是_______。小火煮沸的作用是使沉淀颗粒长大,有利于____。
(2)下图是某学生的过滤操作示意图,其操作不规范的是______(填标号)。

a.漏斗末端颈尖未紧靠烧杯壁
b.玻璃棒用作引流
c.将滤纸湿润,使其紧贴漏斗壁
d.滤纸边缘高出漏斗
e.用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(二)过氧化钙的制备

(3)步骤②的具体操作为逐滴加入稀盐酸,至溶液中尚存有少量固体,此时溶液呈____性(填“酸”、“碱”或“中”)。将溶液煮沸,趁热过滤。将溶液煮沸的作用是___________。
(4)步骤③中反应的化学方程式为________,该反应需要在冰浴下进行,原因是_________。
(5)将过滤得到的白色结晶依次使用蒸馏水、乙醇洗涤,使用乙醇洗涤的目的是_______。
(6)制备过氧化钙的另一种方法是:将石灰石煅烧后,直接加入双氧水反应,过滤后可得到过氧化钙产品。该工艺方法的优点是______,产品的缺点是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某强酸性无色溶液中可能含下表中的若干种离子。
阳离子 | Mg2+、NH4+、Ba2+、Al3+、Fe2+ |
阴离子 | SiO32-、MnO4-、Cl-、NO3-、SO32-、 |
实验Ⅰ:取少量该试液进行如下实验。
实验Ⅱ:为了进一步确定该溶液的组成,取100mL原溶液,向该溶液中滴加1mol·L-1的NaOH溶液,产生沉淀的质量与氢氧化钠溶液体积的关系如图所示。

回答下列问题:
(1)不进行实验就可以推断出,上表中的离子一定不存在的有____________种。
(2)通过实验Ⅰ可以确定该溶液中一定存在的阴离子是________________。
(3)写出实验Ⅱ的图像中BC段对应的离子方程式:_______________________________________________________________。
(4)A点对应的固体质量为____________g。
(5)该溶液中阴离子的浓度为____________mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属和合金是生活中常用的材料。下列说法正确的是
A.不锈钢是铁合金,只含金属元素
B.镧镍(La-Ni)合金能大量吸收H2形成金属氢化物,可作储氢材料
C.目前世界上使用量最大的合金是铝合金
D.常温下,铁粉可以和水发生置换反应得到氢气
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com