
【题目】用电子式表示下列离子化合物的形成过程:
BaCl2_____________________________;
NaF__________________________________;
MgS________________________________;
K2O_________________________________。
(学法题)请归纳物质电子式的书写及用电子式表示化合物的形成过程应注意哪些问题(至少两点)_______、__________________________
【答案】![]()
![]()
![]()
![]() 书写离子的电子式时,主族元素的简单阳离子的电子式就是其离子符号,主族元素的简单阴离子的电子式应在符号外加[ ],然后在[ ]右上角标上电荷符号 用电子式表示离子化合物的形成过程时,左端是原子的电子式,右端是离子化合物的电子式,中间用“→”连接,注意用“
书写离子的电子式时,主族元素的简单阳离子的电子式就是其离子符号,主族元素的简单阴离子的电子式应在符号外加[ ],然后在[ ]右上角标上电荷符号 用电子式表示离子化合物的形成过程时,左端是原子的电子式,右端是离子化合物的电子式,中间用“→”连接,注意用“![]() ”表示电子的转移
”表示电子的转移
【解析】
用电子式表示离子化合物形成过程时,左边是原子的电子式,形成用“→”表示,右边为离子化合物的电子式,要用弯箭头表示电子得失。
氯化钡为离子化合物,Ba原子最外层两个电子被两个Cl原子得到,用电子式表示其形成过程为:![]() ,故答案为:
,故答案为:![]() ;
;
NaF为离子化合物,Na原子最外层一个电子被一个F原子得到,用电子式表示其形成过程为:![]() ,故答案为:
,故答案为:![]() ;
;
MgS为离子化合物,Mg原子最外层两个电子被一个S原子得到,用电子式表示其形成过程为:![]() ,故答案为:
,故答案为:![]() ;
;
K2O为离子化合物,2个K原子最外层上的1个电子被1个O原子得到,用电子式表示其形成过程为:![]() ,故答案为:
,故答案为:![]() ;
;
书写离子的电子式时,主族元素的简单阳离子的电子式就是其离子符号,如Na+、Mg2+,主族元素的简单阴离子的电子式应在符号外加[ ],然后在[ ]右上角标上电荷符号,如![]() ,故答案为:书写离子的电子式时,主族元素的简单阳离子的电子式就是其离子符号,主族元素的简单阴离子的电子式应在符号外加[ ],然后在[ ]右上角标上电荷符号;
,故答案为:书写离子的电子式时,主族元素的简单阳离子的电子式就是其离子符号,主族元素的简单阴离子的电子式应在符号外加[ ],然后在[ ]右上角标上电荷符号;
用电子式表示离子化合物的形成过程时,左端是原子的电子式,右端是离子化合物的电子式,中间用“→”连接,注意用“![]() ”表示电子的转移,故答案为:用电子式表示离子化合物的形成过程时,左端是原子的电子式,右端是离子化合物的电子式,中间用“→”连接,注意用“
”表示电子的转移,故答案为:用电子式表示离子化合物的形成过程时,左端是原子的电子式,右端是离子化合物的电子式,中间用“→”连接,注意用“![]() ”表示电子的转移。
”表示电子的转移。


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
【题目】今年11月18日射洪撤县设市,于当晚8点的焰火晚会也将庆祝活动推向了高潮。焰火与高中化学中“焰色反应”知识有关。下列有关“焰色反应”说法中正确的是
A.焰色反应实验前铂丝应先用稀硫酸洗涤
B.NaCl与Na2SO4灼烧时火焰颜色相同
C.焰色反应均应透过蓝色钴玻璃观察
D.焰色反应属于复杂的化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由碳、氢、氧3种元素组成的有机物A,相对分子质量为152,其分子中C、H原子个数比为1∶1,氧元素的质量分数为31.58%。A遇FeCl3溶液显紫色,A能与NaHCO3溶液反应,其苯环上的一氯取代物有两种,请回答下列问题:
(1)A的分子式是_______________________________。
(2)A的结构简式为________________________________________。
(3)A可以发生如图所示转化关系,D的分子式为C10H12O3,A与C反应的化学方程式________。

(4)甲、乙两装置均可用作实验室由C制取B的装置,乙图采用甘油浴加热(甘油沸点290 ℃,熔点18.17 ℃),当甘油温度达到反应温度时,将盛有C和浓硫酸混合液的烧瓶放入甘油中,很快达到反应温度。甲、乙两装置相比较,乙装置有哪些优点________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了探究FeSO4和Cu(NO3)2的混合物中各组分的含量,现设计如下流程:
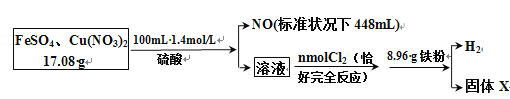
通过计算得出:
(1)原混合物中FeSO4的质量分数约为_______。
(2)通入的 n(Cl2) =________ mol。
(3)生成的H2在标准状况下的体积是________mL。
(4)固体X质量是________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.形式一:(由粒子数推断)A+、B+、C-、D、E5种粒子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:①A++ C-→D+E;②B++C-→2D。据此,回答下列问题:写出A+、B+的化学式:____________、____________。
Ⅱ. 形式二:(由元素原子结构推断)A、B、C、D、E、F的原子序数依次增大,它们都是同周期的元素。已知:A、C、F三种原子最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层电子数少4;E元素原子次外层电子数比最外层电子数多2。
(1)写出下列元素的符号:A________,B________,E________。
(2)F在元素周期表中的位置为___________________________________。
(3)写出C的单质和A的最高价氧化物的水化物反应的离子方程式_______。
(4)元素的非金属性为(原子的得电子能力):E________F(填“强于”或“弱于”),请以E、F为例列举元素非金属性强弱的比较方法_________________、___________________(至少2条)。
(学法题)通过Ⅱ的解题你认为推断出本题各元素的关键环节为___________。
III.形式三:(由元素位置推断)下表为元素周期表的一部分:
族 周期 | ||||||||
1 | ① | |||||||
2 | ② | |||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)请画出元素⑦的离子结构示意图________________。
(2)写出元素⑤在周期表中的位置______________。
(3)②、③、⑥的离子半径由大到小的顺序为_________________________。
(4)⑤、⑥、⑦的最高价氧化物对应水化物酸性由强到弱的顺序是______。
(5)①、②、③三种元素形成化合物与④的最高价氧化物反应的离子方程式为_________。
(6)请你预测:如果发现了原子序数为116号元素,它在周期表中的位置是第________周期_______族,它属于_____元素(填“金属”或“非金属”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期元素化合价与原子序数的关系图,下列说法不正确的是
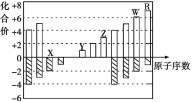
A. 气态氢化物的稳定性:R>W
B. X与Y可以形成原子个数比为1:1和1:2的两种离子化合物
C. 由X、Y、Z、W、R五种元素形成的简单离子中半径最小的是X2-
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Fe 2(SO4) 3样品含有少量FeSO4杂质,为了测定该样品中铁元素的含量,设计如下实验:
Ⅰ.称取样品m g,加入稀H2SO4,后加水配制成250.00 mL溶液;
Ⅱ.取25.00 mL溶液,先加入H2O2,然后再加过量的氨水,过滤;
Ⅲ.将沉淀用蒸馏水洗涤数次后,烘干;
Ⅳ.灼烧至质量不再减少为止,得到红棕色固体,冷却后称量,质量为n g。
请根据上面操作流程,回答以下问题:
①步骤Ⅰ中称量使用的仪器是________________,配制用到的仪器有烧杯、玻璃棒、胶头滴管,还要补充的玻璃仪器是____________________。
②步骤Ⅱ中过滤用的仪器有滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是________;加入H2O2的主要目的是_______________________________。
③若要检验溶液中的Fe3+,则应该加入________________试剂。
④步骤Ⅲ中检验该沉淀已经洗涤干净的操作是________________。
⑤计算该样品中铁元素的质量分数的表达式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲是H2O2酶活性受pH影响的曲线,图乙表示在最适温度下、pH=b时H2O2分解产生的O2量随时间的变化.若该酶促反应过程中改变某一初始条件,以下改变正确的是( )
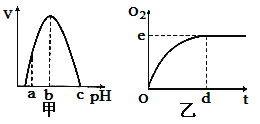
A.pH=a时,e点下移,d点左移
B.H2O2酶量增加时,e点上移,d点左移
C.H2O2量增加时,e点不移,d点左移
D.温度升高时,e点不移,d点右移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)下列各选项有关对应有机物的说法正确的是( )
A |
| 最多有18个原子处在同一平面上 |
B |
| 主链上的碳原子数是5 |
C |
| 加氢后可以得到3-甲基戊烷 |
D |
| 的名称是1,3, 4-三甲基苯 |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com