
【题目】将容积为50mL的量筒内充满NO2和O2的混合气体,倒置量筒在盛满水的水槽里,足够时间后,量筒里剩余气体体积为5mL。则混合气体中NO2和O2体积比可能是( )
A. 13:7B. 15:7
C. 18:7D. 20:7
【答案】C
【解析】
可能发生的反应为:4NO2+O2+2H2O=4HNO3,3NO2+H2O = 2HNO3+NO,试管中O2和NO2气体按体积比1:4混合全部溶解,
若剩余气体为氧气,根据4NO2+O2+2H2O=4HNO3,求出参加此反应的O2,最后相加得到原来的氧气;
若为NO,先根据3NO2+H2O = 2HNO3+NO求出过量的NO2,然后根据4NO2+O2+2H2O=4HNO3求氧气体积,进而计算NO2的体积,据此解答。
NO2和O2与水的反应属于循环反应,可简化为:4NO2+O2+2H2O=4HNO3,对该反应来说,若NO2剩余,则实际是NO,由3NO2+H2O = 2HNO3+NO可知,剩余NO气体是5mL,说明剩余的NO2为:5mL×3=15mL,其余的35mL气体中V(NO2):V(O2)=4:1,则混合气体中氧气的体积为:35mL×![]() =7mL,二氧化氮的体积为:50mL-7mL=43mL,则原混合气体中NO2和O2体积比为:43mL:7mL=43:7;
=7mL,二氧化氮的体积为:50mL-7mL=43mL,则原混合气体中NO2和O2体积比为:43mL:7mL=43:7;
若剩余气体是O2,则反应的45mL中V(NO2):V(O2)=4:1,原混合气体中二氧化氮的体积为:45mL×![]() =36mL,氧气为:50mL-36mL=14mL,
=36mL,氧气为:50mL-36mL=14mL,
则原混合气体中NO2和O2体积比为:36mL:14mL=18:7;
所以C选项是正确的。


科目:高中化学 来源: 题型:
【题目】Ⅰ.形式一:(由粒子数推断)A+、B+、C-、D、E5种粒子(分子或离子),它们分别含10个电子,已知它们有如下转化关系:①A++ C-→D+E;②B++C-→2D。据此,回答下列问题:写出A+、B+的化学式:____________、____________。
Ⅱ. 形式二:(由元素原子结构推断)A、B、C、D、E、F的原子序数依次增大,它们都是同周期的元素。已知:A、C、F三种原子最外层共有11个电子,且这三种元素的最高价氧化物的水化物之间两两皆能反应,均生成盐和水;D元素原子的最外层电子数比次外层电子数少4;E元素原子次外层电子数比最外层电子数多2。
(1)写出下列元素的符号:A________,B________,E________。
(2)F在元素周期表中的位置为___________________________________。
(3)写出C的单质和A的最高价氧化物的水化物反应的离子方程式_______。
(4)元素的非金属性为(原子的得电子能力):E________F(填“强于”或“弱于”),请以E、F为例列举元素非金属性强弱的比较方法_________________、___________________(至少2条)。
(学法题)通过Ⅱ的解题你认为推断出本题各元素的关键环节为___________。
III.形式三:(由元素位置推断)下表为元素周期表的一部分:
族 周期 | ||||||||
1 | ① | |||||||
2 | ② | |||||||
3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
请参照元素①-⑧在表中的位置,用化学用语回答下列问题:
(1)请画出元素⑦的离子结构示意图________________。
(2)写出元素⑤在周期表中的位置______________。
(3)②、③、⑥的离子半径由大到小的顺序为_________________________。
(4)⑤、⑥、⑦的最高价氧化物对应水化物酸性由强到弱的顺序是______。
(5)①、②、③三种元素形成化合物与④的最高价氧化物反应的离子方程式为_________。
(6)请你预测:如果发现了原子序数为116号元素,它在周期表中的位置是第________周期_______族,它属于_____元素(填“金属”或“非金属”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某Fe 2(SO4) 3样品含有少量FeSO4杂质,为了测定该样品中铁元素的含量,设计如下实验:
Ⅰ.称取样品m g,加入稀H2SO4,后加水配制成250.00 mL溶液;
Ⅱ.取25.00 mL溶液,先加入H2O2,然后再加过量的氨水,过滤;
Ⅲ.将沉淀用蒸馏水洗涤数次后,烘干;
Ⅳ.灼烧至质量不再减少为止,得到红棕色固体,冷却后称量,质量为n g。
请根据上面操作流程,回答以下问题:
①步骤Ⅰ中称量使用的仪器是________________,配制用到的仪器有烧杯、玻璃棒、胶头滴管,还要补充的玻璃仪器是____________________。
②步骤Ⅱ中过滤用的仪器有滤纸、铁架台、铁圈和烧杯,还要补充的玻璃仪器是________;加入H2O2的主要目的是_______________________________。
③若要检验溶液中的Fe3+,则应该加入________________试剂。
④步骤Ⅲ中检验该沉淀已经洗涤干净的操作是________________。
⑤计算该样品中铁元素的质量分数的表达式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1,2-二溴乙烷在常温下是无色液体,密度是2.18g/cm3,沸点是131.4℃,熔点是9.79℃,不溶于水,易溶于醇、丙酮等有机溶剂。在实验室可用如图所示装置来制备1,2-二溴乙烷,其中试管c中装有浓溴水。
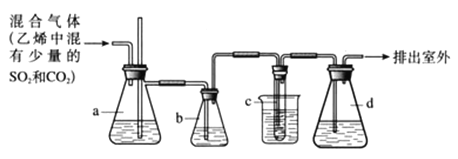
(1)写出制备1,2-二溴乙烷的化学方程式_________________________;
(2)安全瓶a可以防止倒吸,并可以检查实验进行时试管c是否发生堵塞。如果发生堵塞,a中的现象是:____________________________;
(3)容器b中NaOH溶液的作用是____________________________;
(4)将试管c置于冷水中的目的是___________________________;
(5)容器d中NaOH溶液的作用是____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图甲是H2O2酶活性受pH影响的曲线,图乙表示在最适温度下、pH=b时H2O2分解产生的O2量随时间的变化.若该酶促反应过程中改变某一初始条件,以下改变正确的是( )
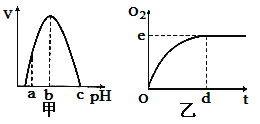
A.pH=a时,e点下移,d点左移
B.H2O2酶量增加时,e点上移,d点左移
C.H2O2量增加时,e点不移,d点左移
D.温度升高时,e点不移,d点右移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2016·天津卷) 下表为元素周期表的一部分。
碳 | 氮 | Y | |
X | 硫 | Z |
回答下列问题:
(1)Z元素在周期表中的位置为__________。
(2)表中元素原子半径最大的是(写元素符号)__________。
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__________。
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1 mol Y单质比1 mol S得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1 mol X的最高价化合物,恢复至室温,放热687 kJ,已知该化合物的熔、沸点分别为69 ℃和58 ℃,写出该反应的热化学方程式:__________。
(5)碳与镁形成的1 mol化合物Q与水反应,生成2 mol Mg(OH)2和1 mol烃,该烃分子中碳氢质量比为9∶1,烃的电子式为__________。Q与水反应的化学方程式为__________。
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由上表中两种元素组成,气体的相对分子质量都小于50。为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1 L 2.2 mol/L NaOH溶液和1 mol O2,则两种气体的分子式及物质的量分别为__________,生成硫酸铜物质的量为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是

选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
D. | 草酸溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下列模型并结合有关信息进行判断,下列说法错误的是( )
HCN | S8 | SF6 | B12结构单元 | |
结构模 型示意 图 |
|
|
|
|
备注 | / | 易溶于CS2 | / | B的熔点为1873K |
A.HCN的结构式为H—C≡N
B.固态S8属于原子晶体
C.SF6是由极性键构成的非极性分子
D.单质硼属于原子晶体,其结构单元中含有30个B—B键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com