
| A、一定浓度的醋酸钠溶液可使酚酞溶液变红,其原因是发生了如下反应:CH3COO-+H2O?CH3COOH+OH-,使得溶液中的c(OH-)>c(H+) |
| B、在常温下,10mL 0.02mol/L HCl溶液与10mL 0.02 mol/L Ba(OH)2溶液充分混合,若混合后溶液的体积为20mL,则溶液的pH=12 |
| C、在0.1mol/L NH4Cl溶液中:c(H+)+c(NH4+)=c(Cl-)+c(OH-) |
| D、将0.2mol/L的盐酸与0.1mol/L的NaAlO2溶液等体积混合,其溶液中离子浓度由小到大的顺序为:c(OH-)<c(Al3+)<c(H+)<c(Na+)<c(Cl-) |
| 0.0002mol |
| 0.02L |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
| 可能用到的燃烧热 | C2H4 | C3H6 | C3H8 |
| 单位:KJ/mol | 1411 | 2092 | 2220 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溶液的pH增加 |
| B、促进CH3COOH的电离 |
| C、溶液的导电能力减弱 |
| D、溶液中c(OH-)减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、纳米材料是指一种称为“纳米”的新物质制成的材料 |
| B、绿色食品是指不含任何化学物质的食品 |
| C、生物固氮是指植物将空气中的氮气转变为氮的化合物 |
| D、光导纤维是以玻璃为主要原料制成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属镁与稀盐酸反应:有气泡逸出Mg+2H++2Cl-═MgCl2+H2↑ |
| B、氯化钡溶液与稀硫酸反应:有白色沉淀生成Ba2++SO42-═BaSO4↓ |
| C、碳酸钠溶液与盐酸反应:有气泡逸出Na2CO3+2H+═2Na++CO2↑+H2O |
| D、NaHCO3溶液中加入过量的Ba(OH)2溶液:有白色沉淀产生2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
12 6 |
13 6 |
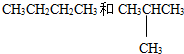 D.甲烷和庚烷E.液氯与氯气
D.甲烷和庚烷E.液氯与氯气 和
和 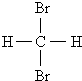
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com