
【题目】某绿色农药结构简式如图,回答下列问题。

(1)基态硒原子价电子排布式为__________,该农药组成元素中,第一电离能较大的前三种元素是________(按由大到小顾序排列)。
(2)分子中编号为①的碳原子和与其成键的另外几个原子构成的空间结构为_________;CSe2首次是由H2Se 和CCl4 反应制取的,试比较上述三种分子的键角_____________(按由大到小顺序排列)。
(3)H2SeO3 分子的中心原子杂化类型是____________,试比较H2SeO3、H2SeO4 和H2SO4三种酸的酸性强弱(按由强到弱顺序排列)_______________。
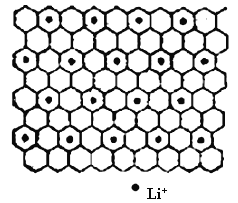
(4)石墨是碳元素的一种同素异形体,石墨晶体可看作ABABA...堆积方式。碱金属离子可填充在石墨层问形成石墨夹层化合物,同时堆积方式从ABABAB...变为AAAA...。下图为石墨夹层化合物W 的投影图,试写出W 的学式_____,微粒之间存在的化学键有______。
【答案】4s24p4F>N>O四面体形Cse2> CCl4> H2Sesp3H2SO4> H2SeO4> H2SeO3C8Li离子键和共价键
【解析】
(1)硒为34号元素,基态硒原子价电子排布式为4s24p4,由元素的非金属性的强弱可知电负性:F>O>N,由于氮原子最外层电子处于半充满的较稳定状态,使得氮的第一电离能大于氧,所以第一电离能:F>N>O故答案为:4s24p4、F>N>O;(2)编号为①的碳原子全部以单键的形式与其它原子相结合,故空间结构为四面体形,CSe2分子为直线形分子,H2Se为V形分子,CCl4为正四面体形分子,故三种分子的键角由大到小为:Cse2> CCl4> H2Se;故答案为:四面体形、Cse2> CCl4> H2Se;(3)H2SeO3 分子的中心原子的价层电子对数为(6+2+3×0)÷2=4,则H2SeO3 分子的中心原子杂化类型是sp3;H2SeO3、H2SeO4和H2SO4三种酸的非羟基氧原子数分别是1、2、2,非金属性:S>Se,所以酸性:H2SO4>H2SeO4>H2SeO3,故答案为:sp3、 H2SO4> H2SeO4> H2SeO3;(4)平均每4个六元环含有1个Li+,每个六元环平均含有2个碳原子,所以W的化学式为C8Li,微粒之间存在的化学键有金属原子与非金属原子之间形成的离子键和非金属原子之间的共价键,故答案为:C8Li 、离子键和共价键。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】常温下氢氧化锌在碱性溶液中的变化如图所示,横坐标为溶液的pH,纵坐标为Zn2+或Zn022-的物质的量浓度的对数,下列说法正确的是
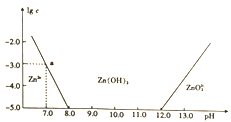
A. 依图中数据计算可得该温度下Zn(OH)2的溶度积(Ksp)=1×10-17
B. 溶液中加入足量氨水,发生反应的离子方程式为Zn2++40H-=ZnO22-+2H2O
C. 为提取工业废液中的Zn2+,可以控制溶液的pH在13左右
D. Zn2+在溶液中的存在形式与Al3+相似,碱性溶液中只以Zn(OH)2形式存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在酸性溶液中,下列物质氧化KI时,自身发生如下变化:Fe3+→Fe2+;MnO4-→Mn2+;Cl2→2Cl-;HNO2→NO,如果分别用等物质的量的这些物质氧化足量的KI,得到I2最多的是( ).
A.Fe3+B. MnO4-C.Cl2D.HNO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式中的ΔH能表示可燃物的燃烧热的是( )
A. ![]() H2(g)+
H2(g)+![]() Cl2(g)===HCl(g) ΔH=-184.6 kJ·mol-1
Cl2(g)===HCl(g) ΔH=-184.6 kJ·mol-1
B. CH4(g)+2O2(g)===2H2O(g)+CO2(g) ΔH=-802 kJ·mol-1
C. CO(g)+![]() O2(g)===CO2(g) ΔH=-283 kJ·mol-1
O2(g)===CO2(g) ΔH=-283 kJ·mol-1
D. 2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑥六种元素在周期表中的位置:
族 周期 | ⅠA | 0 | ||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ||||
请按要求回答下列问题。
⑴元素②的单质电子式是_________。
⑵元素⑤与⑥气态氢化物的热稳定性比较(填化学式):_________。
⑶这六种元素中,位于第三周期且原子半径最小元素的原子结构示意图_____。
⑷这六种元素中,能与氧结合,生成物可做耐火材料的是(填元素符号)_________。
⑸在盛有水的小烧杯中加入元素③的单质,发生反应的离子方程式为_________; 向上述反应后的溶液中再通入元素⑥的单质,发生反应的化学方程式为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是 ( )
A. 硝酸铝溶液中加入过量氨水:Al3++4NH3·H2O==AlO2-+4NH4++2H2O
B. 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O==HClO+HSO3-
C. 钠投入CuSO4溶液中:2Na+Cu2++2H2O==2Na++Cu(OH)2↓+H2↑
D. 铁和过量稀HNO3反应后,溶液pH=2: 3Fe+8H++2NO3-==3Fe2++2NO↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. 下列各组物质的分离或提纯,应选用下述方法的哪一种?(填选项字母)
A. 萃取 B. 加热 C. 结晶 D. 分液 E. 过滤 F. 蒸馏
(1)除去食盐水中的泥沙____。
(2)从含有少量氯化钠的硝酸钾溶液中提取硝酸钾____。
(3)分离水和汽油____。
(4)分离 CCl4 (沸点为76.75℃)和甲苯(沸点为110.6℃)的液体混合物____。
Ⅱ. 实验室欲用 NaOH 固体来配制 100 mL 0.5 mol·L1 的 NaOH 溶液。
(1)配制过程中使用的仪器除托盘天平、烧杯、玻璃棒、量筒、胶头滴管外,还必须用到的玻璃仪器有____。
(2)下列主要操作步骤的正确顺序是____。(填序号)
①称取一定质量的氢氧化钠固体,放入烧杯中,用适量蒸馏水溶解;
②将容量瓶塞盖好,反复上下颠倒,摇匀;
③溶液冷却至室温,将溶液转移到容量瓶中;
④用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并将每次洗涤的溶液都注入容量瓶中;
⑤加水至液面接近容量瓶刻度线1~2厘米处,改用胶头滴管滴加蒸馏水至溶液的凹液面正好与刻度线相切。
(3)在配制过程中,若其他操作均正确,则下列操作会引起结果偏高的是____。
A.没有洗涤烧杯和玻璃棒
B.未等 NaOH 溶液冷却至室温就转移到容量瓶中
C.溶解氢氧化钠搅拌时,液体部分溅出
D.定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C5H10O2的有机物为具有水果香味的油状液体,它与过量的NaOH溶液共热后蒸馏,若得到的有机物蒸气与氢气的摩尔质量之比为23,则有机物C5H10O2的结构简式可以是( )
A. HCOOCH2CH(CH3)2B. CH3CH2COOCH2CH3
C. CH3COOCH2CH2CH3D. CH3COOCH(CH3)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com