
【题目】分子式为C5H10O2的有机物为具有水果香味的油状液体,它与过量的NaOH溶液共热后蒸馏,若得到的有机物蒸气与氢气的摩尔质量之比为23,则有机物C5H10O2的结构简式可以是( )
A. HCOOCH2CH(CH3)2B. CH3CH2COOCH2CH3
C. CH3COOCH2CH2CH3D. CH3COOCH(CH3)2
科目:高中化学 来源: 题型:
【题目】某绿色农药结构简式如图,回答下列问题。

(1)基态硒原子价电子排布式为__________,该农药组成元素中,第一电离能较大的前三种元素是________(按由大到小顾序排列)。
(2)分子中编号为①的碳原子和与其成键的另外几个原子构成的空间结构为_________;CSe2首次是由H2Se 和CCl4 反应制取的,试比较上述三种分子的键角_____________(按由大到小顺序排列)。
(3)H2SeO3 分子的中心原子杂化类型是____________,试比较H2SeO3、H2SeO4 和H2SO4三种酸的酸性强弱(按由强到弱顺序排列)_______________。
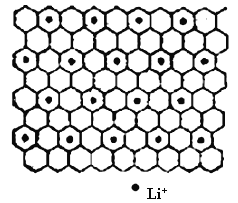
(4)石墨是碳元素的一种同素异形体,石墨晶体可看作ABABA...堆积方式。碱金属离子可填充在石墨层问形成石墨夹层化合物,同时堆积方式从ABABAB...变为AAAA...。下图为石墨夹层化合物W 的投影图,试写出W 的学式_____,微粒之间存在的化学键有______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是实验室制备氯气并进行一系列相关实验的装置(部分夹持仪器已略)

(1)装置 B 中饱和食盐水的作用是____。
(2)装置 D 的作用是验证氯气是否具有漂白性,为此 D 中Ⅰ、Ⅱ、Ш 处依次放入物质的组合应是____(填字母编号)。
编号 | Ⅰ | Ⅱ | Ш |
a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
b | 干燥的有色布条 | 无水氯化钙 | 湿润的有色布条 |
c | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(3)设计装置 F 的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开E中活塞,将装置E 中少量溶液加入装置F中,振荡,观察到的现象是 ____,该现象____(填“能”或“不能”)说明溴单质的氧化性强于碘单质,原因是____。
(4)实验室也可以用高锰酸钾和浓盐酸反应来制备氯气,反应的化学方程式为:2KMnO4 + 16HCl(浓) = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
①在化学方程式上用双线桥法标出该反应中电子转移的方向和数目 ____。
②在该反应中,氧化剂是____。
③上述反应中,有126. 4 g 的 KMnO4 参加反应,若将生成的氯气全部通入足量的石灰乳中,理论上可得到次氯酸钙多少克?_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下列空白。
(1)标准状况下,0.5 mol H2占有的体积是____L。
(2)标准状况下,1 mol O2、N2、H2的混合气体所占体积约为________L。
(3)标准状况下,4.48 L CO2的物质的量是______mol。
(4)标准状况下,16 g O2的体积是________L。
(5)标准状况下,11.2 L N2中含N2的分子数是________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法正确的是( )
A. 含0.1 mol Na2O2的晶体中阳离子与阴离子总数为0.4NA
B. 46 g NO2和N2O4的混合气体中含有的氧原子数为2NA
C. 1 mol Fe与一定量硝酸恰好完全反应时,转移电子数一定为3NA
D. 1 mol CH4与过量氯气发生取代反应,生成CH3Cl气体的体积约为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为了探究SO2和氯水的漂白性,设计了如图实验装置。
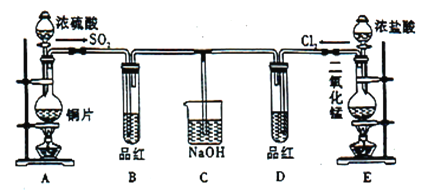
(1)写出A中反应的化学方程式__________,浓硫酸表现出__________性。
(2)实验室用装置E制备Cl2,离子方程式为_____________________________,生成标准状况下2.24 L气体时需要还原剂_________mol。
(3)①装置A中使用前需检漏的仪器是_________(填名称)。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:_______,D:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验室以一种工业上的废渣(废渣主要含有MgCO3、MgSiO3和少量Fe、Al的氧化物)为原料,制备MgCO3·3H2O。实验流程如下图所示:

(1)为了加快废渣的酸溶速率,可采取的办法有_________(任写一点),酸溶时废渣中主要成分发生反应的离子方程式为___________________________________。
(2)加入30%H2O2的目的是__________________________________。
(3)用萃取分液的方法除去溶液中的Fe3+, 萃取分液完成后,检验水相中是否含有Fe3+的最佳试剂是_______。
(4)室温下,除去MgSO4溶液中的A13+(使Al3+浓度小于1×10-6mol/L)而不引入其它杂质,应加入的试剂X为_____________________。
(5)右图为不同反应温度下所得水合碳酸镁的X射线衍射谱图。由图可知,干燥时需控制温度范围为_______,温度较高时MgCO3·3H2O发生转化的化学方程式为_______________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的沸点逐渐升高的是
A. NH3 PH3 AsH3 SbH3B. CH4 SiH4 GeH4 SnH4
C. CI4 CBr4 CF4 CCl4D. HF HCl HBr HI
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,正确的是
A. 澄清的石灰水跟盐酸反应:H++OH-= H2O
B. 氯气与水反应:Cl2+H2O = 2H++Cl-+ClO-
C. 碳酸钡与稀盐酸反应:CO32-+2H+ = H2O+CO2↑
D. 金属钠跟水反应:Na+H2O = Na++OH-+H2↑
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com