
【题目】填写下列空白。
(1)标准状况下,0.5 mol H2占有的体积是____L。
(2)标准状况下,1 mol O2、N2、H2的混合气体所占体积约为________L。
(3)标准状况下,4.48 L CO2的物质的量是______mol。
(4)标准状况下,16 g O2的体积是________L。
(5)标准状况下,11.2 L N2中含N2的分子数是________个。
【答案】11.222.40.211.23.01×1023
【解析】
(1)标准状况下Vm=22.4L/mol,0.5 mol H2占有的体积是0.5 mol L×22.4L/mol=11.2L; (2)标准状况下Vm=22.4L/mol,1 mol O2、N2、H2的混合气体所占体积约为1 mol×22.4L/mol=22.4L; (3)标准状况下Vm=22.4L/mol,4.48 L CO2的物质的量是![]() =0.2mol;(4)标准状况下Vm=22.4L/mol,氧气的M=32g/mol,则V=
=0.2mol;(4)标准状况下Vm=22.4L/mol,氧气的M=32g/mol,则V=![]() ;(5)标准状况下Vm=22.4L/mol,11.2 L N2中含N2的分子数是
;(5)标准状况下Vm=22.4L/mol,11.2 L N2中含N2的分子数是![]() =3.01×1023个。
=3.01×1023个。


科目:高中化学 来源: 题型:
【题目】下列热化学方程式中的ΔH能表示可燃物的燃烧热的是( )
A. ![]() H2(g)+
H2(g)+![]() Cl2(g)===HCl(g) ΔH=-184.6 kJ·mol-1
Cl2(g)===HCl(g) ΔH=-184.6 kJ·mol-1
B. CH4(g)+2O2(g)===2H2O(g)+CO2(g) ΔH=-802 kJ·mol-1
C. CO(g)+![]() O2(g)===CO2(g) ΔH=-283 kJ·mol-1
O2(g)===CO2(g) ΔH=-283 kJ·mol-1
D. 2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. 下列各组物质的分离或提纯,应选用下述方法的哪一种?(填选项字母)
A. 萃取 B. 加热 C. 结晶 D. 分液 E. 过滤 F. 蒸馏
(1)除去食盐水中的泥沙____。
(2)从含有少量氯化钠的硝酸钾溶液中提取硝酸钾____。
(3)分离水和汽油____。
(4)分离 CCl4 (沸点为76.75℃)和甲苯(沸点为110.6℃)的液体混合物____。
Ⅱ. 实验室欲用 NaOH 固体来配制 100 mL 0.5 mol·L1 的 NaOH 溶液。
(1)配制过程中使用的仪器除托盘天平、烧杯、玻璃棒、量筒、胶头滴管外,还必须用到的玻璃仪器有____。
(2)下列主要操作步骤的正确顺序是____。(填序号)
①称取一定质量的氢氧化钠固体,放入烧杯中,用适量蒸馏水溶解;
②将容量瓶塞盖好,反复上下颠倒,摇匀;
③溶液冷却至室温,将溶液转移到容量瓶中;
④用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并将每次洗涤的溶液都注入容量瓶中;
⑤加水至液面接近容量瓶刻度线1~2厘米处,改用胶头滴管滴加蒸馏水至溶液的凹液面正好与刻度线相切。
(3)在配制过程中,若其他操作均正确,则下列操作会引起结果偏高的是____。
A.没有洗涤烧杯和玻璃棒
B.未等 NaOH 溶液冷却至室温就转移到容量瓶中
C.溶解氢氧化钠搅拌时,液体部分溅出
D.定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)某双原子分子构成的气体,其摩尔质量为M g·mol-1,该气体质量为m g,阿伏加德罗常数为NA,则:
①该气体的物质的量为________mol。
②该气体在标准状况下的体积为________L。
③该气体在标准状况下的密度为________g·L-1。
④该气体所含原子总数为________个。
⑤该气体的一个分子的质量为________g。
(2)在273 K和101 kPa的条件下,将2.00 g氦气、1.40 g氮气和1.60 g氧气混合,试计算该混合气体的体积。______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
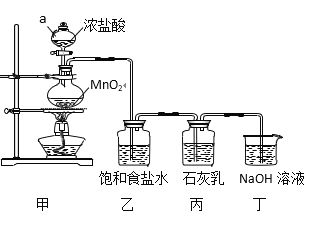
【题目】某兴趣小组模拟工业制漂白粉,设计了下列图5的实验装置。已知:①氯气和碱反应放出热量。②6Cl2+6Ca(OH)2![]() 5CaCl2+Ca(ClO3)2+6H2O。
5CaCl2+Ca(ClO3)2+6H2O。
回答下列问题:
(1)甲装置中仪器a的名称是_______,MnO2在反应中所起的作用是(填“氧化剂”或“还原剂”)______________。
(2)装置乙中饱和食盐水的作用是____________________________。
(3)①制取漂白粉的化学方程式是____________________________。
②该小组制得的漂白粉中n(CaCl2) 远大于n[Ca(ClO)2],其主要原因是_________。
③为提高Ca(ClO)2的含量,可采取的措施是_______________(任写一种即可)。
(4)漂白粉应密封保存,原因是______________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E、F六种前四周期元素,它们的原子序数依次增大。A、D同主族,A元素的原子最外层p能级的电子数等于次外层的电子总数,C原子最外层中有两个未成对的电子且与A同周期;C元素可分别与A、B、D、E生成RC2型化合物,并知EC2中E与C的质量比为1/1;F能形成红色(或砖红色)和黑色的两种氧化物。根据以上条件,回答下列问题:
(1)请写出F元素的名称 ___________F元素电子排布式___________________________
(2)在EC2分子中,E原子的杂化轨道类型为_________,分子的空间构型为 _______;
(3)H2E和H2C2的主要物理性质比较如下:
熔点/K | 沸点/K | 标准状况时在水中的溶解度 | |
H2E | 187 | 202 | 2.6 |
H2C2 | 272 | 423 | 以任意比互溶 |
H2E和H2C2的相对分子质量基本相同,造成上述几种物理性质差异的主要原因 _____________ 。
(4)元素A的一种氢化物是重要的化工原料,常把该氢化物的产量作为衡量石油化工发展水平的标志。有关该氢化物分子的说法正确的是 (_______________)
A.分子中含有分子间氢键 C.只含有4个sp-s的σ键和1个p-p的π键
B.属于含有极性键的非极性分子 D.该氢化物分子中A原子采用sp2杂化
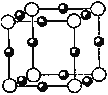
(5)B和F形成某种化合物的晶胞结构如右图所示(每个球均表示1个原子,其中B显-3价),则其化学式为 __________。F的常见离子和B的最简单氢化物形成的配离子的名称为___________,其水溶液颜色为________________。
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C5H10O2的有机物为具有水果香味的油状液体,它与过量的NaOH溶液共热后蒸馏,若得到的有机物蒸气与氢气的摩尔质量之比为23,则有机物C5H10O2的结构简式可以是( )
A. HCOOCH2CH(CH3)2B. CH3CH2COOCH2CH3
C. CH3COOCH2CH2CH3D. CH3COOCH(CH3)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】缩醛在有机合成中常用于保护羰基或作为合成中间体,同时还是一类重要的香料,广泛应用于化妆品、食物、饮料等行业。G是一种常用的缩醛,分子中含有一个六元环和一个五元环结构。下面是G的一种合成路线:
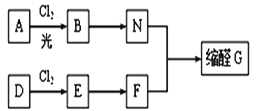
已知:①芳香烃A含氢元素的质量分数为8.7%,A的质谱图中,分子离子峰对应的最大质荷比为92; D的产重可以用来衡量一个国家的石油化工发展水平。
②同一个碳原子连接两个羟基不稳定,易脱水形成羰基。
③
回答下列问题:
(1)A的结构简式是_____________________,E的名称是____________________________。
(2)由D生成E的反应类型是________,E→F的反应条件是_________________________。
(3)由B生成N的化学方程式为___________________________。
(4)有研究发现,维生素C可以作为合成G物质的催化剂,具有价廉、效率高、污染物少的优点。维生素C的结构如右图。则维生素C分子中含氧官能团名称为_____________。

(5)缩醛G的结构简式为______________。G有多种同分异构体,写出其中能同时满足以下条件的所有同分异构体的结构简式:_________________________。
①既能发生银镜反应,又能与FeC13发生显色反应;②核磁共振氢谐为4组峰。
(6)写出用2-丁烯为原料(其他无机试剂任选)制备顺丁橡胶(顺式聚1,3-丁二烯)的合成路线:__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com