
【题目】(1)某双原子分子构成的气体,其摩尔质量为M g·mol-1,该气体质量为m g,阿伏加德罗常数为NA,则:
①该气体的物质的量为________mol。
②该气体在标准状况下的体积为________L。
③该气体在标准状况下的密度为________g·L-1。
④该气体所含原子总数为________个。
⑤该气体的一个分子的质量为________g。
(2)在273 K和101 kPa的条件下,将2.00 g氦气、1.40 g氮气和1.60 g氧气混合,试计算该混合气体的体积。______________________
【答案】![]()
![]()
![]()
![]()
![]() 2.00 g氦气的物质的量:n(He)=m/M(He)=2.00 g/4 g·mol-1=0.5 mol;1.40 g氮气的物质的量为:n(N2)=m/M(N2)=1.40 g/28 g·mol-1=0.05 mol;1.60 g氧气的物质的量为:n(O2)=m/M(O2)=1.60 g/32 g·mol-1=0.05 mol;标准状况下Vm=22.4 L·mol-1,因此气体的总体积为:V=n·Vm=(0.5 mol+0.05 mol+0.05 mol)×22.4 L·mol-1=13.44 L答:混合气体的体积是13.44 L。
2.00 g氦气的物质的量:n(He)=m/M(He)=2.00 g/4 g·mol-1=0.5 mol;1.40 g氮气的物质的量为:n(N2)=m/M(N2)=1.40 g/28 g·mol-1=0.05 mol;1.60 g氧气的物质的量为:n(O2)=m/M(O2)=1.60 g/32 g·mol-1=0.05 mol;标准状况下Vm=22.4 L·mol-1,因此气体的总体积为:V=n·Vm=(0.5 mol+0.05 mol+0.05 mol)×22.4 L·mol-1=13.44 L答:混合气体的体积是13.44 L。
【解析】
(1)根据n=![]() 计算出该气体的物质的量;根据V=22.4L/mol×n计算出标况下气体的体积;根据ρ=
计算出该气体的物质的量;根据V=22.4L/mol×n计算出标况下气体的体积;根据ρ=![]() 计算出该气体的密度;根据N=n(原子)NA,计算出含有的原子数,注意该气体是双原子分子;根据总质量和气体的分子个数计算出一个分子的质量。
计算出该气体的密度;根据N=n(原子)NA,计算出含有的原子数,注意该气体是双原子分子;根据总质量和气体的分子个数计算出一个分子的质量。
(1)①该气体的物质的量为:n=![]() =
=![]() mol;②该气体在标准状况下的体积为:V=22.4L/mol×=
mol;②该气体在标准状况下的体积为:V=22.4L/mol×=![]() mol=
mol=![]() L;③该气体在标准状况下的密度为:ρ=
L;③该气体在标准状况下的密度为:ρ=![]() =
=![]() =
=![]() g/L;③该气体所含原子总数为:N=n(原子)NA=
g/L;③该气体所含原子总数为:N=n(原子)NA=![]() mol×2×NA=
mol×2×NA=![]() ;④该气体含有的分子个数为:
;④该气体含有的分子个数为:![]() mol×NA=
mol×NA=![]() ,一个气体分子的质量为:
,一个气体分子的质量为:![]() =
=![]() g; (2)2.00 g氦气的物质的量:n(He)=m/M(He)=2.00 g/4 g·mol-1=0.5 mol;1.40 g氮气的物质的量为:n(N2)=m/M(N2)=1.40 g/28 g·mol-1=0.05 mol;1.60 g氧气的物质的量为:n(O2)=m/M(O2)=1.60 g/32 g·mol-1=0.05 mol;标准状况下Vm=22.4 L·mol-1,因此气体的总体积为:V=n·Vm=(0.5 mol+0.05 mol+0.05 mol)×22.4 L·mol-1=13.44 L答:混合气体的积是13.44 L。
g; (2)2.00 g氦气的物质的量:n(He)=m/M(He)=2.00 g/4 g·mol-1=0.5 mol;1.40 g氮气的物质的量为:n(N2)=m/M(N2)=1.40 g/28 g·mol-1=0.05 mol;1.60 g氧气的物质的量为:n(O2)=m/M(O2)=1.60 g/32 g·mol-1=0.05 mol;标准状况下Vm=22.4 L·mol-1,因此气体的总体积为:V=n·Vm=(0.5 mol+0.05 mol+0.05 mol)×22.4 L·mol-1=13.44 L答:混合气体的积是13.44 L。


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】下列实验过程中产生的现象与图形相符合的是( )
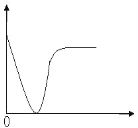
A. 稀硫酸滴加到 B a ( O H ) 2 溶液中(横坐标是稀硫酸的体积,纵坐标为溶液的导电能力)
B. 铁粉加到一定量 CuSO4 溶液中(横坐标是铁粉的质量,纵坐标为沉淀质量)
C. CO2 通入一定量 NaOH 溶液中(横坐标是 CO2 的体积,纵坐标为溶液的导电能力)
D. 稀盐酸滴加到一定量 NaOH 溶液中(横坐标是稀盐酸的体积,纵坐标为钠离子物质的量)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2F2分子中四个原子都在同一平面内,由于几何形状的不同,存在顺式和反式两种同分异构体。据此判断N2F2分子中两个N原子之间化学键的组成为( )
A. 一个σ键和两个π键B. 仅有一个σ键
C. 仅有一个π键D. 一个σ键和一个π键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图中,B、D、E、F、G是氧化物且B为红棕色固体,F、K是氢化物且F为常温常压下常见无色液体,C、H是日常生活中最常见的金属单质,J是黄绿色气体。O是白色沉淀且B、H、L、M、N、O中含有同种元素,I是基础化学工业的重要产品(图中部分反应物和生成物没有列出)。
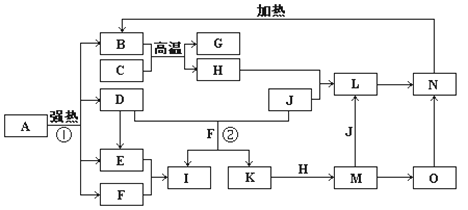
请按要求回答:
(1)写出G、L的化学式G:_____________________,L:______________________
(2)反应②的离子方程式 ________________________________________________。
(3)写出反应M→L的离子方程式为________________________________________。
(4)若将O敞口久置,变质过程中的现象为___________________________________
发生的化学方程式为__________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是实验室制备氯气并进行一系列相关实验的装置(部分夹持仪器已略)

(1)装置 B 中饱和食盐水的作用是____。
(2)装置 D 的作用是验证氯气是否具有漂白性,为此 D 中Ⅰ、Ⅱ、Ш 处依次放入物质的组合应是____(填字母编号)。
编号 | Ⅰ | Ⅱ | Ш |
a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
b | 干燥的有色布条 | 无水氯化钙 | 湿润的有色布条 |
c | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(3)设计装置 F 的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开E中活塞,将装置E 中少量溶液加入装置F中,振荡,观察到的现象是 ____,该现象____(填“能”或“不能”)说明溴单质的氧化性强于碘单质,原因是____。
(4)实验室也可以用高锰酸钾和浓盐酸反应来制备氯气,反应的化学方程式为:2KMnO4 + 16HCl(浓) = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
①在化学方程式上用双线桥法标出该反应中电子转移的方向和数目 ____。
②在该反应中,氧化剂是____。
③上述反应中,有126. 4 g 的 KMnO4 参加反应,若将生成的氯气全部通入足量的石灰乳中,理论上可得到次氯酸钙多少克?_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃、101 kPa条件下,将15 L O2通入10 L CO和H2的混合气体中,使其完全燃烧,干燥后,恢复至原来的温度和压强。
(1)若剩余气体的体积是15 L,则原CO和H2的混合气体中V(CO)=________ L,V(H2)=________ L。
(2)若剩余气体的体积为a L,则原CO和H2的混合气体中V(CO)∶V(H2)=________。
(3)若剩余气体的体积为a L,则a的取值范围是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下列空白。
(1)标准状况下,0.5 mol H2占有的体积是____L。
(2)标准状况下,1 mol O2、N2、H2的混合气体所占体积约为________L。
(3)标准状况下,4.48 L CO2的物质的量是______mol。
(4)标准状况下,16 g O2的体积是________L。
(5)标准状况下,11.2 L N2中含N2的分子数是________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验小组的同学为了探究SO2和氯水的漂白性,设计了如图实验装置。
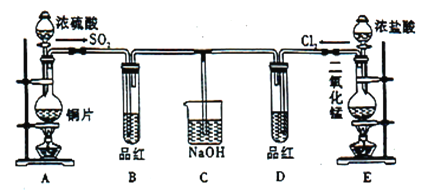
(1)写出A中反应的化学方程式__________,浓硫酸表现出__________性。
(2)实验室用装置E制备Cl2,离子方程式为_____________________________,生成标准状况下2.24 L气体时需要还原剂_________mol。
(3)①装置A中使用前需检漏的仪器是_________(填名称)。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为B:_______,D:______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向5 mL NaCl溶液中滴入一滴AgNO3溶液,出现白色沉淀,继续滴加一滴KI溶液并振荡,沉淀变为黄色,再滴入一滴Na2S溶液并振荡,沉淀又变成黑色,根据上述变化过程,分析此三种沉淀物的溶解度关系为
A. AgCl=AgI=Ag2S B. AgCl<AgI<Ag2S
C. AgCl>AgI>Ag2S D. AgI>AgCl>Ag2S
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com