
【题目】某兴趣小组模拟工业制漂白粉,设计了下列图5的实验装置。已知:①氯气和碱反应放出热量。②6Cl2+6Ca(OH)2![]() 5CaCl2+Ca(ClO3)2+6H2O。
5CaCl2+Ca(ClO3)2+6H2O。
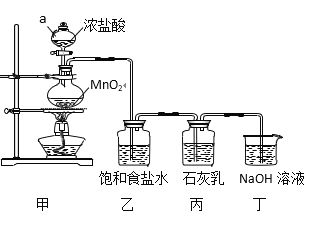
回答下列问题:
(1)甲装置中仪器a的名称是_______,MnO2在反应中所起的作用是(填“氧化剂”或“还原剂”)______________。
(2)装置乙中饱和食盐水的作用是____________________________。
(3)①制取漂白粉的化学方程式是____________________________。
②该小组制得的漂白粉中n(CaCl2) 远大于n[Ca(ClO)2],其主要原因是_________。
③为提高Ca(ClO)2的含量,可采取的措施是_______________(任写一种即可)。
(4)漂白粉应密封保存,原因是______________________(用化学方程式表示)。
【答案】分液漏斗 氧化剂 除去氯气中混有的氯化氢 2Cl2+2 Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 氯气和碱反应会放出热量,导致温度升高,发生了副反应:6Cl2+6 Ca(OH)2![]() 5CaCl2+Ca(ClO3)2+6H2O 将丙装置浸在盛有冷水的水槽中或控制氯气产生速率 Ca(ClO)2 +CO2+H2O= CaCO3+2HClO
5CaCl2+Ca(ClO3)2+6H2O 将丙装置浸在盛有冷水的水槽中或控制氯气产生速率 Ca(ClO)2 +CO2+H2O= CaCO3+2HClO
【解析】
模拟工业制漂白粉:装置A制取Cl2,a为分液漏斗,可以控制加入的浓盐酸,圆底烧瓶中盛放二氧化锰,反应的方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,HCl易挥发,制得的氯气中含有氯化氢,可以用食盐水来除杂,乙装置除去氯气中的氯化氢,丙装置Cl2与Ca(OH)2的反应制漂白粉,Cl2有毒,需进行尾气处理,装置丁吸收多余的氯气。
MnCl2+Cl2↑+2H2O,HCl易挥发,制得的氯气中含有氯化氢,可以用食盐水来除杂,乙装置除去氯气中的氯化氢,丙装置Cl2与Ca(OH)2的反应制漂白粉,Cl2有毒,需进行尾气处理,装置丁吸收多余的氯气。
(1)根据仪器的特征以及常见仪器的名称解答;MnO2与浓盐酸反应生成氯化镁、氯气与水,MnO2是氧化剂;
(2)HCl易挥发,制得的氯气中含有氯化氢,可以用食盐水来除杂;
(3)①漂白粉的主要成分是次氯酸钙Ca(ClO)2和氯化钙,氯气与石灰乳反应产物是氯化钙、次氯酸钙和水;
②根据氯气和碱反应放出热量,温度稍高即发生副反应6Cl2+6 Ca(OH)2![]() 5CaCl2+Ca(ClO3)2+6H2O进行判断;
5CaCl2+Ca(ClO3)2+6H2O进行判断;
③因为温度高时易生成Ca(ClO3)2,所以避免此反应发生可以采取降温措施或控制反应避免反应放热瞬时升高;
(4)漂白粉有效成分为次氯酸钙,能够与空气中的二氧化碳反应而导致变质。
(1)甲装置中仪器a具有球形特征,有玻璃活塞,在该实验中,可以控制加入的浓盐酸,为分液漏斗,装置A制取Cl2,反应的方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,反应中,MnO2中Mn元素化合价降低(+4→+2),MnO2为氧化剂,
MnCl2+Cl2↑+2H2O,反应中,MnO2中Mn元素化合价降低(+4→+2),MnO2为氧化剂,
因此,本题正确答案是:分液漏斗;氧化剂;
(2)浓盐酸和二氧化锰反应过程中会发出氯化氢气体,氯化氢在氯化钠饱和溶液中易溶,而氯气难溶,通过饱和食盐水的作用是除去Cl2中混有的HCl气体,
因此,本题正确答案是:除去氯气中混有的氯化氢;
(3)①漂白粉的主要成分是次氯酸钙Ca(ClO)2和氯化钙,将氯气通入石灰乳[Ca(OH)2]制取漂白粉,同时有水生成,反应的化学方程式为:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,
因此,本题正确答案是:2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
②氯气和碱反应会放出热量,导致温度升高,当温度低时,氯气和氢氧化钙反应生成氯化钙和次氯酸钙和水;当温度高时,发生了副反应: 6Cl2+6 Ca(OH)2![]() 5CaCl2+Ca(ClO3)2+6H2O,所以制得的漂白粉中n(CaCl2) 远大于n[Ca(ClO)2],
5CaCl2+Ca(ClO3)2+6H2O,所以制得的漂白粉中n(CaCl2) 远大于n[Ca(ClO)2],
因此,本题正确答案是:氯气和碱反应会放出热量,导致温度升高,发生了副反应:6Cl2+6 Ca(OH)2![]() 5CaCl2+Ca(ClO3)2+6H2O;
5CaCl2+Ca(ClO3)2+6H2O;
③温度较高时氯气与消石灰反应生成Ca(ClO3)2,为避免此副反应的发生,用冰水或冷水冷却,或控制氯气产生速率,通过控制反应速率,避免反应放热瞬时升高,
因此,本题正确答案是:将丙装置浸在盛有冷水的水槽中或控制氯气产生速率;
(4)漂白粉有效成分为次氯酸钙,HClO虽是强氧化性的酸,但它是比碳酸还弱的酸,受空气中的水、CO2作用而导致变质,生成CaCO3和HClO,该反应的化学方程式为:Ca(ClO)2 +CO2+H2O= CaCO3+2HClO,所以漂白粉应密封保存,
因此,本题正确答案是: Ca(ClO)2 +CO2+H2O= CaCO3+2HClO。


科目:高中化学 来源: 题型:
【题目】迷迭香酸是从蜂花属植物中提取的物质,其结构简式如图所示。则等量的迷迭香酸消耗的Br2、NaOH、NaHCO3的物质的量之比为

A. 7:6:1 B. 7:6:5 C. 6:7:1 D. 6:7:5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是实验室制备氯气并进行一系列相关实验的装置(部分夹持仪器已略)

(1)装置 B 中饱和食盐水的作用是____。
(2)装置 D 的作用是验证氯气是否具有漂白性,为此 D 中Ⅰ、Ⅱ、Ш 处依次放入物质的组合应是____(填字母编号)。
编号 | Ⅰ | Ⅱ | Ш |
a | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
b | 干燥的有色布条 | 无水氯化钙 | 湿润的有色布条 |
c | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
d | 湿润的有色布条 | 无水氯化钙 | 干燥的有色布条 |
(3)设计装置 F 的目的是比较氯、溴、碘单质的氧化性。反应一段时间后,打开E中活塞,将装置E 中少量溶液加入装置F中,振荡,观察到的现象是 ____,该现象____(填“能”或“不能”)说明溴单质的氧化性强于碘单质,原因是____。
(4)实验室也可以用高锰酸钾和浓盐酸反应来制备氯气,反应的化学方程式为:2KMnO4 + 16HCl(浓) = 2KCl + 2MnCl2 + 5Cl2↑ + 8H2O
①在化学方程式上用双线桥法标出该反应中电子转移的方向和数目 ____。
②在该反应中,氧化剂是____。
③上述反应中,有126. 4 g 的 KMnO4 参加反应,若将生成的氯气全部通入足量的石灰乳中,理论上可得到次氯酸钙多少克?_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于粗盐提纯,下列说法正确的是( )
A.溶解粗盐时,应尽量使溶液稀些,防止食盐不完全溶解
B.滤去不溶性杂质后,将滤液移至坩埚内加热浓缩
C.当蒸发到剩有少量液体时,停止加热利用余热将液体蒸干
D.粗盐经溶解、过滤、蒸发后,制得的精盐为纯净的氯化钠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】填写下列空白。
(1)标准状况下,0.5 mol H2占有的体积是____L。
(2)标准状况下,1 mol O2、N2、H2的混合气体所占体积约为________L。
(3)标准状况下,4.48 L CO2的物质的量是______mol。
(4)标准状况下,16 g O2的体积是________L。
(5)标准状况下,11.2 L N2中含N2的分子数是________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列说法正确的是( )
A. 含0.1 mol Na2O2的晶体中阳离子与阴离子总数为0.4NA
B. 46 g NO2和N2O4的混合气体中含有的氧原子数为2NA
C. 1 mol Fe与一定量硝酸恰好完全反应时,转移电子数一定为3NA
D. 1 mol CH4与过量氯气发生取代反应,生成CH3Cl气体的体积约为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学实验室以一种工业上的废渣(废渣主要含有MgCO3、MgSiO3和少量Fe、Al的氧化物)为原料,制备MgCO3·3H2O。实验流程如下图所示:

(1)为了加快废渣的酸溶速率,可采取的办法有_________(任写一点),酸溶时废渣中主要成分发生反应的离子方程式为___________________________________。
(2)加入30%H2O2的目的是__________________________________。
(3)用萃取分液的方法除去溶液中的Fe3+, 萃取分液完成后,检验水相中是否含有Fe3+的最佳试剂是_______。
(4)室温下,除去MgSO4溶液中的A13+(使Al3+浓度小于1×10-6mol/L)而不引入其它杂质,应加入的试剂X为_____________________。
(5)右图为不同反应温度下所得水合碳酸镁的X射线衍射谱图。由图可知,干燥时需控制温度范围为_______,温度较高时MgCO3·3H2O发生转化的化学方程式为_______________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌铜原电池产生电流时,阳离子( )
A. 移向Zn极,阴离子移向Cu极B. 移向Cu极,阴离子移向Zn极
C. 和阴离子都移向Zn极D. 和阴离子都移向Cu极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com