
【题目】由C6H5—、—C6H4—、—CH2—、—OH四种原子团(各1个)组成的属于酚的物质有( )
A. 1种 B. 2种
C. 3种 D. 4种
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源,下图为海水利用的部分过程。
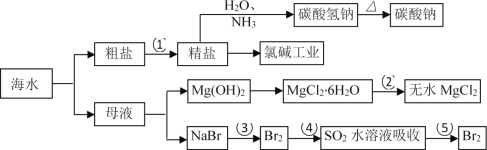
已知:MgCl2 · 6H2O 受热生成 Mg(OH)Cl 和 HCl 气体等。下列有关说法正确的是( )
A. 工业上将石灰水加入到海水中得到 Mg(OH)2 沉淀
B. 在过程②中将 MgCl2 · 6H2O 灼烧即可制得无水 MgCl2
C. 在第③、④、⑤步骤中,溴元素均被氧化
D. 制取 NaHCO3 的反应是利用其溶解度小于 NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑥六种元素在周期表中的位置:
族 周期 | ⅠA | 0 | ||||||
1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
2 | ① | ② | ||||||
3 | ③ | ④ | ⑤ | ⑥ | ||||
请按要求回答下列问题。
⑴元素②的单质电子式是_________。
⑵元素⑤与⑥气态氢化物的热稳定性比较(填化学式):_________。
⑶这六种元素中,位于第三周期且原子半径最小元素的原子结构示意图_____。
⑷这六种元素中,能与氧结合,生成物可做耐火材料的是(填元素符号)_________。
⑸在盛有水的小烧杯中加入元素③的单质,发生反应的离子方程式为_________; 向上述反应后的溶液中再通入元素⑥的单质,发生反应的化学方程式为_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应:3A(g)+B(g)![]() 2C(g)+xD(g),达到平衡时,生成了2 mol C,经测定,D的浓度为0.5 mol·L-1,下列判断正确的是( )。
2C(g)+xD(g),达到平衡时,生成了2 mol C,经测定,D的浓度为0.5 mol·L-1,下列判断正确的是( )。
A. x=1
B. B的转化率为20%
C. 平衡时A的浓度为1.50 mol·L-1
D. 达到平衡时,在相同温度下容器内混合气体的压强是反应前的85%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. 下列各组物质的分离或提纯,应选用下述方法的哪一种?(填选项字母)
A. 萃取 B. 加热 C. 结晶 D. 分液 E. 过滤 F. 蒸馏
(1)除去食盐水中的泥沙____。
(2)从含有少量氯化钠的硝酸钾溶液中提取硝酸钾____。
(3)分离水和汽油____。
(4)分离 CCl4 (沸点为76.75℃)和甲苯(沸点为110.6℃)的液体混合物____。
Ⅱ. 实验室欲用 NaOH 固体来配制 100 mL 0.5 mol·L1 的 NaOH 溶液。
(1)配制过程中使用的仪器除托盘天平、烧杯、玻璃棒、量筒、胶头滴管外,还必须用到的玻璃仪器有____。
(2)下列主要操作步骤的正确顺序是____。(填序号)
①称取一定质量的氢氧化钠固体,放入烧杯中,用适量蒸馏水溶解;
②将容量瓶塞盖好,反复上下颠倒,摇匀;
③溶液冷却至室温,将溶液转移到容量瓶中;
④用少量蒸馏水洗涤烧杯内壁和玻璃棒2~3次,并将每次洗涤的溶液都注入容量瓶中;
⑤加水至液面接近容量瓶刻度线1~2厘米处,改用胶头滴管滴加蒸馏水至溶液的凹液面正好与刻度线相切。
(3)在配制过程中,若其他操作均正确,则下列操作会引起结果偏高的是____。
A.没有洗涤烧杯和玻璃棒
B.未等 NaOH 溶液冷却至室温就转移到容量瓶中
C.溶解氢氧化钠搅拌时,液体部分溅出
D.定容时俯视刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,所含分子数一定相同的是( )
A. 1 g H2和8 g O2
B. 0.1 mol HCl和2.24 L He
C. 150 ℃,1.01×105 Pa时,18 L H2O和18 L CO2
D. 常温常压下,28 g CO和6.02×1022个CO分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组模拟工业制漂白粉,设计了下列图5的实验装置。已知:①氯气和碱反应放出热量。②6Cl2+6Ca(OH)2![]() 5CaCl2+Ca(ClO3)2+6H2O。
5CaCl2+Ca(ClO3)2+6H2O。
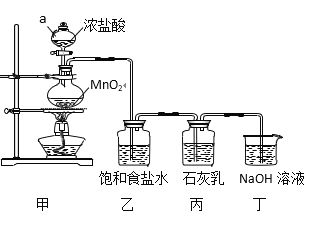
回答下列问题:
(1)甲装置中仪器a的名称是_______,MnO2在反应中所起的作用是(填“氧化剂”或“还原剂”)______________。
(2)装置乙中饱和食盐水的作用是____________________________。
(3)①制取漂白粉的化学方程式是____________________________。
②该小组制得的漂白粉中n(CaCl2) 远大于n[Ca(ClO)2],其主要原因是_________。
③为提高Ca(ClO)2的含量,可采取的措施是_______________(任写一种即可)。
(4)漂白粉应密封保存,原因是______________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的数值。下列说法正确的是
A. 标准状况下,11.2L苯中含有分子的数目为0.5NA
B. 常温常压下,1.6g由氧气和臭氧组成的混合物中含有氧原子的数目为0.1NA
C. 在过氧化钠与水的反应中,每生成0.1mol氧气,转移电子数目为0.4NA
D. 25℃时,pH=13的氢氧化钠溶液中含有OH-的数目为0.1NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com