
埋在地下的钢管常用如图所示的方法加以保护,使其免受腐蚀。关于此方法,下列说法正确的是( )
A.金属棒X的材料可能为铜
B.金属棒X的材料可能为钠
C.钢管附近土壤的pH可能会上升
D.这种方法称为外加电流的阴极保护法
解析:图中没有外加电源,为牺牲阳极的阴极保护法,X的活泼性应大于铁的活泼性,但金属钠活泼性太强,能与土壤中的H2O直接反应,故A、B、D项说法错误;O2在钢管处得电子,发生还原反应:O2+4e-+2H2O==4OH-,C项说法正确。
答案:C
点拨:本题重点考查了电化学腐蚀的有关内容。常见的电化学腐蚀有两类:(1)形成原电池时,金属作负极,大多数是吸氧腐蚀;(2)形成电解池时,金属作阳极。根据上述的腐蚀类型采取的电化学防护方法有:(1)牺牲阳极的阴极保护法,被保护的金属与较活泼的金属相连,较活泼的金属作负极时被腐蚀,被保护的金属作正极;(2)外加电流的阴极保护法,被保护的金属与外接电源的负极相连,作阴极。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
“钴酞菁(分子直径1.3×10–9m)”分子结构和性质与人体内的血红素及植物体内的叶绿素
非常相似,我国科学家在世界上第一次为“钴酞菁”分子恢复了磁性。下列关于“钴酞菁”的说法正确的是 ( )
A.在水中形成的分散系属于悬浊液 B.分子直径比Na+小
C.“钴酞菁”分子不能透过滤纸 D.在水中形成的分散系具有丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
已知热化学方程式:
①CO(g)+ O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
②H2(g)+ O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
则下列说法正确的是( )
A.H2的燃烧热为241.8 kJ·mol-1
B.由反应①、②可知如图所示的热化学方程式为CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1

C.H2(g)转变成H2O(g)的化学反应一定释放能量
D.根据②推知反应H2(g)+ O2(g)===H2O(l) ΔH>-241.8 kJ·mol-1
O2(g)===H2O(l) ΔH>-241.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
容积均为1 L的甲、乙两个恒容容器中,分别充入2 mol A、2 mol B和1 mol A、1 mol B,相同条件下,发生下列反应:A(g)+B(g)===xC(g) ΔH<0。测得两容器中c(A)随时间t的变化如图所示,下列说法不正确的是( )
A.x=1
B.此条件下,该反应的平衡常数K=4
C.给乙容器升温可缩短反应达平衡的时间但不能提高平衡转化率
D.甲和乙中B的平衡转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
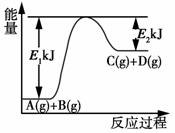
已知某反应A(g)+B(g)===C(g)+D(g),反应过程中的能量变化如图所示,回答下列问题。
(1)该反应是________反应(填“吸热”或“放热”),该反应的ΔH=________kJ·mol-1(用含E1、E2的代数式表示),1 mol气体A和1 mol气体B具有的总能量比1 mol气体C和1 mol气体D具有的总能量________(填“一定高”、“一定低”或“高低不一定”)。
(2)若在反应体系中加入催化剂使反应速率增大,则E1和E2的变化是:E1________,E2________,ΔH________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g) ΔH=a kJ·mol-1
3AlCl(g)===2Al(l)+AlCl3(g) ΔH=b kJ·mol-1
①反应Al2O3(s)+3C(s)===2Al(l)+3CO(g)的ΔH=________kJ·mol-1(用含a、b的代数式表示)。
②Al4C3是反应过程中的中间产物。Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为______________________________________________
___________________________________________________________________。
(2)镁铝合金(Mg17Al12)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为Mg17Al12+17H2===17MgH2+12Al。得到的混合物Y(17MgH2+12Al)在一定条件下可释放出氢气。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是________________________。
②在6.0 mol·L-1 HCl溶液中,混合物Y能完全释放出H2。1 mol Mg17Al12完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出H2的物质的量为________。
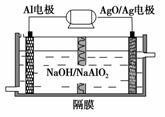
(3)铝电池性能优越,AlAgO电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为_________________________________________
_______________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
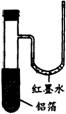
用一张已除去表面氧化膜的铝箔紧紧包裹在试管外壁(如图),将试管浸人硝酸汞溶液中,片刻取出,然后置于空气中,不久铝箔表面生出“白毛”,红墨水柱右端上升。根据实验现象判断下列说法错误的是( )。
A.实验中发生的反应都是氧化还原反应
B.铝是一种较活泼的金属
C.铝与氧气反应放出大量的热量
D.铝片上生成的“白毛”是氧化铝和氧化汞的混合物
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com