
铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g) ΔH=a kJ·mol-1
3AlCl(g)===2Al(l)+AlCl3(g) ΔH=b kJ·mol-1
①反应Al2O3(s)+3C(s)===2Al(l)+3CO(g)的ΔH=________kJ·mol-1(用含a、b的代数式表示)。
②Al4C3是反应过程中的中间产物。Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为______________________________________________
___________________________________________________________________。
(2)镁铝合金(Mg17Al12)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为Mg17Al12+17H2===17MgH2+12Al。得到的混合物Y(17MgH2+12Al)在一定条件下可释放出氢气。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是________________________。
②在6.0 mol·L-1 HCl溶液中,混合物Y能完全释放出H2。1 mol Mg17Al12完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出H2的物质的量为________。
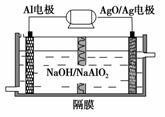
(3)铝电池性能优越,AlAgO电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为_________________________________________
_______________________________________________________。
【解析】 (1)已知:①Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g) ΔH=a kJ·mol-1;
②3AlCl(g)===2Al(l)+AlCl3(g) ΔH=b kJ·mol-1,根据盖斯定律,由①+②可得:Al2O3(s)+3C(s)===2Al(l)+3CO(g) ΔH=(a+b) kJ·mol-1。
含氢量最高的烃为CH4,据此可知Al4C3与盐酸发生的反应为Al4C3+12HCl===4AlCl3+3CH4↑。
(2)①Mg、Al都是活泼金属,高温时易与空气中的O2反应,通入氩气的目的是隔绝空气,防止Mg、Al被氧化。②1 mol Mg17Al12完全吸氢后得到的混合物Y中含有17 mol MgH2和12 mol Al,与6.0 mol·L-1盐酸反应时,生成MgCl2、AlCl3和H2,则生成H2的物质的量为17 mol+17 mol+12 mol×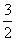 =52 mol。
=52 mol。
(3)由铝电池原理图可知,Al作负极,AgO/Ag作正极,电池反应式为2Al+3AgO+2NaOH===2NaAlO2+3Ag+H2O。
【答案】 (1)①a+b
②Al4C3+12HCl===4AlCl3+3CH4↑
(2)①防止Mg、Al被空气氧化 ②52 mol
(3)2Al+3AgO+2NaOH===2NaAlO2+3Ag+H2O


 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
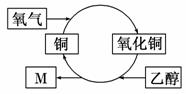
某化学反应过程如右图所示。由图得出的判断,错误的是( )
A.铜是此反应的催化剂
B.乙醇发生了还原反应
C.生成物M的化学式为C2H4O
D.反应中有红黑交替变化的现象
查看答案和解析>>
科目:高中化学 来源: 题型:
埋在地下的钢管常用如图所示的方法加以保护,使其免受腐蚀。关于此方法,下列说法正确的是( )
A.金属棒X的材料可能为铜
B.金属棒X的材料可能为钠
C.钢管附近土壤的pH可能会上升
D.这种方法称为外加电流的阴极保护法
查看答案和解析>>
科目:高中化学 来源: 题型:
向0.1 mol·L-1 CH3COOH溶液中加入少量的CH3COONa晶体时,会引起
( )
A.溶液的pH增大 B.溶液中的c(H+)增大
C.溶液的导电能力减弱 D.溶液中的c(OH-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
下列表示0.1 mol/L NaHCO3溶液中有关微粒浓度(mol/L)的关系式中,正确的是( )
A.c(Na+)>c(HCO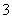 )>c(CO
)>c(CO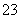 )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
B.c(Na+)+c(H+)=c(HCO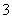 )+c(CO
)+c(CO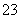 )+c(OH-)
)+c(OH-)
C.c(Na+)+c(H+)=c(HCO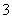 )+2c(CO
)+2c(CO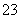 )+c(OH-)
)+c(OH-)
D.c(Na+)=c(HCO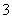 )+2c(CO
)+2c(CO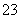 )+c(H2CO3)
)+c(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
在压强为2.20×104 kPa、温度达到374℃时,水成为“超临界状态”,此时水可将CO2等含碳化合物转化为有机物,这就是“水热反应”。生物质在地下高温高压条件下通过水热反应可生成石油、煤等矿物能源。下列说法不正确的是( )
A.二氧化碳与超临界水作用生成汽油的反应,属于放热反应
B.“水热反应”是一种复杂的化学变化
C.火力发电厂可望利用废热,将二氧化碳转变为能源物质
D.随着科技的进步,“水热反应”制取能源有望实现地球上碳资源的和谐循环
查看答案和解析>>
科目:高中化学 来源: 题型:
相同温度下,体积均为0.25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g)2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始时的有关数据如表所示:
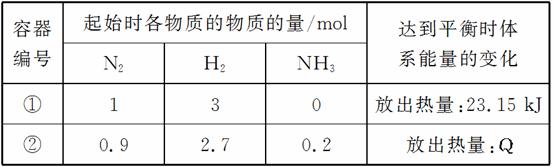
下列叙述错误的是( )
A.容器①②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为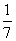
C.容器②中达到平衡时放出的热量Q=23.15 kJ
D.若容器①体积为0.5 L,则平衡时放出的热量小于23.15 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
在a L的密闭容器里,于一定温度下进行2A(g)+B(g)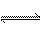 2C(g)的可逆反应。容器内开始加入下列各组物质,在达到平衡时逆反应速率最大的一组物质是( )
2C(g)的可逆反应。容器内开始加入下列各组物质,在达到平衡时逆反应速率最大的一组物质是( )
A.2 mol A和1 mol B B.1 mol A和1 mol B
C.1 mol A和2 mol B D.1 mol B和1 mol C
查看答案和解析>>
科目:高中化学 来源: 题型:
在溶液中加入足量Na2O2后仍能大量共存的离子组是( )
A.NH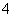 、Ba2+、Cl-、NO
、Ba2+、Cl-、NO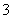
B.K+、AlO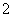 、Cl-、SO
、Cl-、SO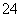
C.Ca2+、Mg2+、NO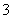 、HCO
、HCO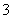
D.Na+、Cl-、CO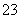 、SO
、SO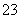
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com