
向0.1 mol·L-1 CH3COOH溶液中加入少量的CH3COONa晶体时,会引起
( )
A.溶液的pH增大 B.溶液中的c(H+)增大
C.溶液的导电能力减弱 D.溶液中的c(OH-)减小
科目:高中化学 来源: 题型:
已知热化学方程式:
①CO(g)+ O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)===CO2(g) ΔH=-283.0 kJ·mol-1
②H2(g)+ O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)===H2O(g) ΔH=-241.8 kJ·mol-1
则下列说法正确的是( )
A.H2的燃烧热为241.8 kJ·mol-1
B.由反应①、②可知如图所示的热化学方程式为CO(g)+H2O(g)===CO2(g)+H2(g) ΔH=-41.2 kJ·mol-1

C.H2(g)转变成H2O(g)的化学反应一定释放能量
D.根据②推知反应H2(g)+ O2(g)===H2O(l) ΔH>-241.8 kJ·mol-1
O2(g)===H2O(l) ΔH>-241.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
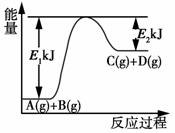
已知某反应A(g)+B(g)===C(g)+D(g),反应过程中的能量变化如图所示,回答下列问题。
(1)该反应是________反应(填“吸热”或“放热”),该反应的ΔH=________kJ·mol-1(用含E1、E2的代数式表示),1 mol气体A和1 mol气体B具有的总能量比1 mol气体C和1 mol气体D具有的总能量________(填“一定高”、“一定低”或“高低不一定”)。
(2)若在反应体系中加入催化剂使反应速率增大,则E1和E2的变化是:E1________,E2________,ΔH________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知25 ℃时,AgCl的溶度积Ksp=1.8×10-10,则下列说法正确的是
( )
A.向饱和AgCl水溶液中加入盐酸,Ksp变大
B.AgNO3溶液与NaCl溶液混合后的溶液中,一定有c(Ag+)=c(Cl-)
C.温度一定时,当溶液中c(Ag+)·c(Cl-)=Ksp时,此溶液中必有AgCl的沉淀析出
D.将AgCl加入到较浓的KI溶液中,部分AgCl转化为AgI,因为AgCl溶解度大于AgI
查看答案和解析>>
科目:高中化学 来源: 题型:
铝是地壳中含量最高的金属元素,其单质及合金在生产生活中的应用日趋广泛。
(1)真空碳热还原氯化法可实现由铝土矿制备金属铝,其相关反应的热化学方程式如下:
Al2O3(s)+AlCl3(g)+3C(s)===3AlCl(g)+3CO(g) ΔH=a kJ·mol-1
3AlCl(g)===2Al(l)+AlCl3(g) ΔH=b kJ·mol-1
①反应Al2O3(s)+3C(s)===2Al(l)+3CO(g)的ΔH=________kJ·mol-1(用含a、b的代数式表示)。
②Al4C3是反应过程中的中间产物。Al4C3与盐酸反应(产物之一是含氢量最高的烃)的化学方程式为______________________________________________
___________________________________________________________________。
(2)镁铝合金(Mg17Al12)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为Mg17Al12+17H2===17MgH2+12Al。得到的混合物Y(17MgH2+12Al)在一定条件下可释放出氢气。
①熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是________________________。
②在6.0 mol·L-1 HCl溶液中,混合物Y能完全释放出H2。1 mol Mg17Al12完全吸氢后得到的混合物Y与上述盐酸完全反应,释放出H2的物质的量为________。
(3)铝电池性能优越,AlAgO电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为_________________________________________
_______________________________________________________。
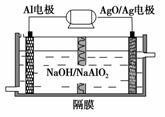
查看答案和解析>>
科目:高中化学 来源: 题型:
在2 L密闭容器中,盛有2 mol X和2 molY物质进行如下反应:2X(s)+3Y(g)Z(g),当反应进行10 s后,测得生成0.5 mol Z,则这期间的平均反应速率为( )
A.v(Z)=0.025 mol/(L·s)
B.v(X)=0.025 mol/(L·s)
C.v(Y)=0.05 mol/(L·s)
D.v(Y)=0.075 mol/(L·s)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com