
【题目】化学与生活、生产密切相关,下列有关说法正确的是:
A. 硫酸工业使用V2O5作催化剂是为了提高SO2的转化率
B. SiO2是人类将太阳能转化为电能的常用材料
C. 卫生洁具的清洁常用盐酸不用醋酸,是因为醋酸的腐蚀性大
D. 小苏打是抗酸药,服用时喝醋将降低药效
 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:
【题目】用CO合成甲醇(CH3OH)的化学方程式为CO(g)+2H2(g)CH3OH(g)△H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示.下列说法正确的是

A.温度: T1>T2>T3
B.正反应速率:υ(b)>υ(d) υ(a)>υ(c)
C.平衡常数:K(a)>K(c) K(b)=K(d)
D.平均摩尔质量: M(b)>M(d) M(a)<M(c)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将6 mol CO2和8 mol H2充入2L恒容密闭容器中,发生反应:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表。
CH3OH(g)+H2O(g) ΔH<0,一段时间后达到平衡。反应过程中测定的数据如下表。

(1)反应前4min的平均速率v(CO2)= ________________ mol/(L·min)
(2)达到平衡时速率之比v(CO2):v(H2):v(CH3OH):v(H2O)=_________
(3)达到平衡时,H2的转化率为____________ ;CO2平衡浓度是_____mol/L
(4)该温度下,该反应的平衡常数为_____________
(5)达到平衡时降低温度,平衡向_______________(填正反应或逆反应)方向移动;达到平衡时速率与原平衡速率比较(填变大,不变或减小)_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在标况下的四种气体①6.72LCH4 ②3.01×1023个HCl分子 ③13.6克H2S④0.2molNH3用相应的序号填写下列空白:
(1)体积最大的是;
(2)原子数最多的是;
(3)质量最小的是;
(4)含氢原子数最少的是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年9月以来,我国很多地区再大面积出现雾霾,特别是华中华北尤其严重,汽车尾气、燃煤废气和冬季取暖排放的CO2等都是形成雾霾的原因。
Ⅰ.用于净化汽车尾气的反应为:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)△H<0,在一定温度下,如图在一体积固定的密闭容器中充入一定量的NO和CO,在t1时刻达到平衡状态。
2CO2(g)+N2(g)△H<0,在一定温度下,如图在一体积固定的密闭容器中充入一定量的NO和CO,在t1时刻达到平衡状态。
(1)能判断该反应达到平衡状态的标志是_______。
A.在单位时间内生成1mol CO2的同时消耗了1mol CO
B.混合气体的密度不再改变
C.混合气体的平均相对分子质量不再改变
D.混合气体的压强不再变化
(2)在t2时刻将容器的容积迅速扩大到原来的2倍,在其他条件不变的情况下,t3时刻达到新的平衡状态,之后不再改变条件.请在图中补充画出从t2到t4时刻正反应速率随时间的变化曲线:___________

Ⅱ.使用石油热裂解的副产物CH4来制取H2,其生产流程如图1所示:
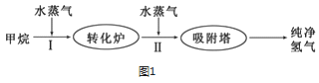
(3)此流程的第Ⅰ步反应为:CH4(g)+H2O(g)![]() CO(g)+3H2(g),一定条件下CH4的平均转化率与温度、压强的关系如图2所示,则P1_____P2(填“>”、“<”或“=”),100℃时,将1molCH4(g)和2molH2O(g)通入容积为100L的恒容的密闭容器中,达到平衡时CH4的转化率为0.5。此时该反应的平衡常数K____________ (写出完整的计算过程)
CO(g)+3H2(g),一定条件下CH4的平均转化率与温度、压强的关系如图2所示,则P1_____P2(填“>”、“<”或“=”),100℃时,将1molCH4(g)和2molH2O(g)通入容积为100L的恒容的密闭容器中,达到平衡时CH4的转化率为0.5。此时该反应的平衡常数K____________ (写出完整的计算过程)

(4)此流程的第Ⅱ步反应的平衡常数随温度的变化情况如下表
温度/℃ | 400 | 500 | 830 |
平衡常数K | 10 | 9 | 1 |
温度/℃ | 400 | 500 | 830 |
平衡常数K | 10 | 9 | 1 |
从表上可以推断该反应是___________(填“吸热”或“放热”)反应,若反应在500℃时进行,设CO(g)和H2O(g)的起始浓度均为0.020mol/L,在该条件下,反应达到平衡时,CO的转化率为________;
(5)图3表反应Ⅱ在t1时达到平衡,在t2时因改变某个条件引起浓度变化的情况,图中t2时改变的条件是降低温度或________________(写一种)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。实验室用足量NaOH溶液吸收从浓盐酸和MnO2反应体系中导出的气体。当吸收温度不同时,生成的产物可能是NaClO、NaClO3、NaCl中的两种或三种。下列说法正确的是
MnCl2+Cl2↑+2H2O。实验室用足量NaOH溶液吸收从浓盐酸和MnO2反应体系中导出的气体。当吸收温度不同时,生成的产物可能是NaClO、NaClO3、NaCl中的两种或三种。下列说法正确的是
A. 若产物为NaClO、NaCl,则吸收后的溶液中n(ClO-)=n(Cl-)
B. 若产物为NaClO3、NaCl,则参加反应的氧化剂和还原剂的物质的量之比为1∶5
C. 若产物为NaClO、NaClO3、NaCl,则由吸收后的溶液中n(Cl-)和n(ClO-)可计算吸收的n(Cl2)
D. 若产物为NaClO、NaClO3、NaCl,则NaOH与Cl2相互反应的物质的量之比为2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化物的叙述正确的是
A. 金属氧化物都是碱性氧化物
B. 与水反应可生成含酸的氧化物都是酸性氧化物
C. 酸性氧化物都可以与强碱反应
D. 不能跟酸反应的氧化物一定能和碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】—种酸性“二甲醚(CH3OCH3)直接燃料电池”具有启动快、能量密度高、效率好等优点,其电池原理如图所示。下列有关该电池的说法不正确的是

A. a电极是该电池的负极
B. b电极上发生的反应为:O2+4H++4e-=2H2O
C. H+由a电极向b电极迁移
D. 电池工作时,电子从a电极→灯泡→b电极→电解液→a电极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com