
| 温度/℃ | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| NaOH/g | 109 | 118 | 129 | 146 | 177 | 300 | 313 | 318 | 337 |
| NaCl/g | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
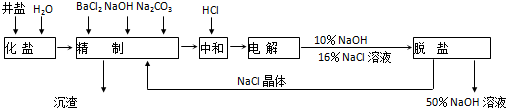
分析 由流程可知,粗盐加水化盐溶解后,加入氯化钡除去硫酸根离子,加NaOH除去镁离子,加碳酸钠除去钙离子,精制后得到的沉渣为CaCO3、Mg(OH)2;精制后的食盐水电解生成NaOH、氢气、氯气,最后脱盐(NaCl等)得到高浓度的NaOH溶液,
(1)在电解过程中,与电源正极相连的电极为阳极,是溶液中的阴离子失电子发生氧化反应;
(2)电解氯化钠溶液总反应的化学方程式为:2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$ 2NaOH+H2↑+Cl2↑;
(3)根据阳极生成氯气来分析;
(4)精制过程就是将杂质离子转化为沉淀除去的过程,Ca2+、Mg2+等杂质与碳酸钠、NaOH反应转化为沉淀;
(5)添加钡试剂除去SO42-,注意不能引入新的杂质;
(6)有效除去Ca2+、Mg2+、SO42-,应注意碳酸钠在钡试剂之后;
(7)根据氢氧化钠和氯化钠的溶解度随温度的变化关系来确定实现氯化钠和氢氧化钠分离获得氯化钠的方法.
解答 解:由流程可知,粗盐加水化盐溶解后,加入氯化钡除去硫酸根离子,加NaOH除去镁离子,加碳酸钠除去钙离子,精制后得到的沉渣为CaCO3、Mg(OH)2;精制后的食盐水电解生成NaOH、氢气、氯气,最后脱盐(NaCl等)得到高浓度的NaOH溶液,
(1)与电源正极相连的电极为阳极,溶液中的阴离子(Cl- OH-)Cl-优先放电,电极反应为:2Cl--2e-=Cl2↑,故答案为:2Cl--2e-=Cl2↑;
(2)饱和食盐水中阴阳离子分别为:Cl-、OH-、Na+、H+,通电后,Cl-、H+ 优先放电生成氯气和氢气,因此电解过程的总反应为2NaCl+2H2O$\frac{\underline{\;电解\;}}{\;}$ 2NaOH+H2↑+Cl2↑,
故答案为:2NaCl+2H2O $\frac{\underline{\;电解\;}}{\;}$ 2NaOH+H2↑+Cl2↑;
(3)阳极产物为氯气,实际上考察氯气的用途:制漂白粉、生产盐酸、自来水消毒、制高纯硅、合成塑料等,
故答案为:制漂白粉、生产盐酸、自来水消毒、制高纯硅、合成塑料等(任写2种);
(4)精制的过程中加入了NaOH、Na2CO3所以离子方程式为Ca2++CO32-=CaCO3↓,Mg2++2OH-=Mg(OH)2↓,
故答案为:Ca2++CO32-=CaCO3↓、Mg2++2OH-=Mg(OH)2↓;
(5)为了防止引入新的杂质,只能加入BaCl2或Ba(OH)2,Cl-不属于杂质离子,OH-最后通过滴加适量的盐酸除去,故答案为:a、c;
(6)物质提纯中依次除杂的原则是:先加的除杂试剂要过量,后加入的除杂试剂不仅能除去原有的杂质离子也能除去新进入的杂质离子,所以粗盐精制的要求是①除去SO42-要在除去Ca2+之前,②最后用盐酸调溶液至中性,所以方法有多种,
故答案为:b、c;
(7)当两种物质都可溶,但溶解度随温度变化差异较大时,常用结晶的方法,故答案为:蒸发结晶;趁热过滤.
点评 本题考查混合物分离提纯的综合应用及海水资源利用等,为高频考点,把握分离流程中的反应及混合物分离方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF | |
| B. | 若将0.2 mol•L-1Na2CO3和0.1 mol•L-1NaHCO3溶液等体积混合,则溶液中:3c(OHˉ)=3c(H+)+2c(HCO3ˉ)+5c(H2CO3)+c(CO32ˉ) | |
| C. | 根据上表,反应ClOˉ+H2O?HClO+OHˉ的水解常数Kh≈10ˉ7.6 | |
| D. | 向上述NaClO 溶液中通HF气体至恰好完全反应时:c(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
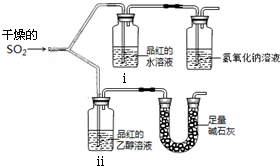 实验小组为探究SO2的漂白性和还原性,设计了以下实验.完成下列填空:
实验小组为探究SO2的漂白性和还原性,设计了以下实验.完成下列填空:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
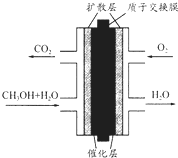 直接甲醇燃料电池(DMFC)有望取代传统电池,它主要由阴极极板、阳极极板和膜电极构成,其中膜电极包括质子膜、催化剂层和气体扩散层(如图).下列关于DMFC工作原理的叙述正确的是( )
直接甲醇燃料电池(DMFC)有望取代传统电池,它主要由阴极极板、阳极极板和膜电极构成,其中膜电极包括质子膜、催化剂层和气体扩散层(如图).下列关于DMFC工作原理的叙述正确的是( )| A. | 通入O2的电极反应式为:O2+4e-+2H2O═4OH- | |
| B. | 电池内部H+由正极渗过交换膜向负极移动 | |
| C. | 甲醇在正极发生反应,电流经过外电路流向负极 | |
| D. | 注入CH3OH的电极反应式为:CH3OH+H2O-6e-═CO2+6H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
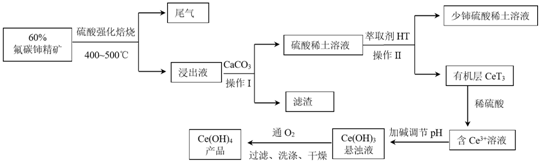
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
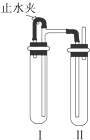 用下面两种方法均可制得Fe(OH)2白色沉淀.
用下面两种方法均可制得Fe(OH)2白色沉淀.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com