
| 溶质 | NaF | NaClO | Na2CO3 |
| pH | 7.5 | 9.7 | 11.6 |
| A. | 在相同温度下,同浓度的三种酸溶液的导电能力顺序:H2CO3<HClO<HF | |
| B. | 若将0.2 mol•L-1Na2CO3和0.1 mol•L-1NaHCO3溶液等体积混合,则溶液中:3c(OHˉ)=3c(H+)+2c(HCO3ˉ)+5c(H2CO3)+c(CO32ˉ) | |
| C. | 根据上表,反应ClOˉ+H2O?HClO+OHˉ的水解常数Kh≈10ˉ7.6 | |
| D. | 向上述NaClO 溶液中通HF气体至恰好完全反应时:c(Na+)>c(Fˉ)>c(H+)>c(HClO)>c(OH-) |
分析 相同浓度的钠盐溶液碱性越强,说明酸根离子水解程度越大,则相应酸的酸性越弱,酸的电离平衡常数越小,根据钠盐溶液的pH知,酸根离子水解程度CO32->ClO->F-,酸的电离平衡常数从小到大顺序是:HCO3-<HClO<HF,以此解答该题.
解答 解:相同浓度的钠盐溶液碱性越强,说明酸根离子水解程度越大,则相应酸的酸性越弱,酸的电离平衡常数越小,根据钠盐溶液的pH知,酸根离子水解程度CO32->ClO->F-,酸的电离平衡常数从小到大顺序是:HCO3-<HClO<HF,
A.酸的电离平衡常数从小到大顺序是:HCO3-<HClO<HF,在相同温度下,同浓度的三种酸溶液的导电能力顺序:HCO3-<HClO<HF,但酸性H2CO3>HClO,故A错误;
B.溶液存在电荷守恒c(Na+)+c(H+)=c(HCO3-)+c(OH-)+2c(CO32-) ①
溶液中还存在物料守恒:3c(Na+)=5c(HCO3-)+5c(CO32- )+5c(H2CO3) ②
将①×3-②可得:3c(OHˉ)-c(CO32- )=3c(H+)+2c(HCO3ˉ)+5c(H2CO3),故B错误;
C.式ClO-+H2O?HClO+OH-的平衡常数为K=$\frac{c(HClO)×c(O{H}^{-})}{c(Cl{O}^{-})}$=$\frac{1{0}^{-4.3}×1{0}^{-4.3}}{0.1}$=10-7.6,故C正确;
D.反应后生成HClO,由于电离程度较弱,则c(HClO)>c(H+),故D错误.
故选C.
点评 本题考查较为综合,涉及弱电解质的电离和盐类的水解,为高频考点,注意从电荷守恒的角度解答,难度不大.


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:选择题
| A. | BaC03是难溶于水的强电解质,在医学上用作钡餐 | |
| B. | 常用电解熔融氯化铝和冰晶石的混合物方法冶炼铝 | |
| C. | 明矾净水,硫酸铜溶液作农药,都与金属离子的水解有关 | |
| D. | 锅炉水垢中含有的CaSO4,可先用饱和碳酸钠溶液处理,而后用盐酸除去 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑦ | B. | ①④⑦ | C. | ①③④⑤⑥ | D. | ②③⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 溶液中[Na+]增大,有O2放出 | B. | 溶液PH值不变,有H2放出 | ||
| C. | 溶液中Na+数目减少,有O2放出 | D. | 溶液中PH值不变,有O2放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
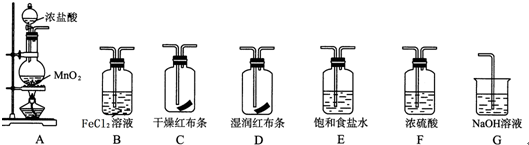
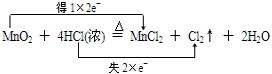 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯、乙醇和乙酸都能发生取代反应 | |
| B. | 等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等 | |
| C. | 乙醇、乙酸和乙酸乙酯能用饱和NaHCO3溶液鉴别 | |
| D. | 乙烷和丙烯的物质的量各1mol,完成燃烧生成3molH2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
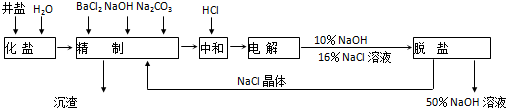
| 温度/℃ | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| NaOH/g | 109 | 118 | 129 | 146 | 177 | 300 | 313 | 318 | 337 |
| NaCl/g | 36 | 36.3 | 36.6 | 37 | 37.3 | 37.8 | 38.4 | 39 | 39.8 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com