
A、B、C、D、E、F六种物质在一定条件下有如图所示的相互转化关系,所有反应物和生成物均已给出。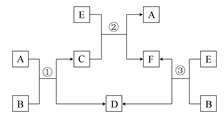
(1)若反应①②③均为水溶液中的置换反应,A、D、E均为卤素单质,则A、D、E的氧化性由强到弱的顺序为 ,其中A的化学式是 。
(2)若B为一种能使湿润的红色石蕊试纸变蓝的气体的水溶液,C是一种溶于强碱不溶于B的白色絮状沉淀,则反应①的离子方程式为 。
(3)若B是水,C是一种有磁性的化合物,E是一种无色、无味的有毒气体,则反应①的化学方程式是 。
(4)若B是一种淡黄色固体,绿色植物的光合作用和呼吸作用可实现自然界中D和E的循环。化合物B的化学式为 ,F的饱和溶液与足量E反应的离子方程式是 。
科目:高中化学 来源: 题型:单选题
X、Y、Z、W有如图所示的转化关系,则X、Y可能是( )
①C、CO ②AlCl3、Al(OH)3
③Na、Na2O ④NaOH 、Na2CO3
A.①②③ B.①②
C.③④ D.①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I是地壳中含量最高的金属,K是一种红棕色气体,过量G与J溶液反应生成M。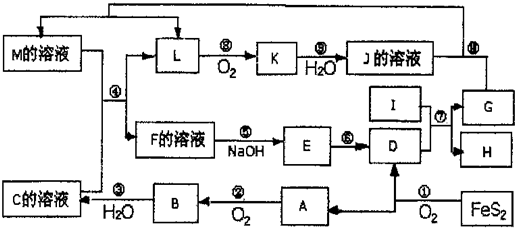
请填写下列空白:
(1)在周期表中,组成单质G的元素位于第_______周期第_______族。
(2)在反应⑦中还原剂与氧化剂的物质的量之比为___________________。
(3)简述M溶液中阳离子的检验方法 。
(4)某同学取F的溶液,酸化后加入KI、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式: 。
(5)将化合物D与KNO3、KOH高温共熔,可制得一种“绿色”环保高效净水剂K2FeO4,同时还生成KNO2和H2O,该反应的化学方程式是_________________________。
(6)镁与金属I的合金是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg与金属I的单质在一定温度下熔炼获得。
①熔炼制备该合金时通入氩气的目的是 。
② I电池性能优越,I-AgO电池可用作水下动力电源,其原理如图所示。该电池反应的化学方程式为 。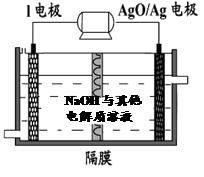
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(10分)X、Y、Z三种元素常见单质在常温下都是气体,在适当条件下可发生如下图所示变化,X、Y、Z为三种短周期元素,它们的原子序数之和为16.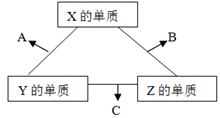
已知一个B分子中含有的Z元素的原子个数比C分子中的少一个。
请回答下列问题:
(1)X元素在周期表中的位置是______________________。
(2)X的单质与Z的单质可制成新型的化学电源(KOH溶液作电解质溶液),两个电极均由多孔性碳制成,通入的气体由孔隙中逸出,并在电极表面放电,则正极通入__________(填物质名称);负极电极反应式为____________________。
(3)C在一定条件下反应生成A的化学方程式是_______________________________。
(4)已知Y的单质与Z的单质生成C的反应是可逆反应,△H<0。将等物质的量的Y、Z的单质充入一密闭容器中,在适当催化剂和恒温、恒压条件下反应。下列说法中,正确的是____________________(填写下列各项的序号)。
a.达到化学平衡时,正反应速率与逆反应速率相等
b.达到化学平衡时,Y、Z的两种单质在混合气体中的物质的量之比为1:1
c.达到化学平衡时,Y的单质的体积分数仍为50%
d.达到化学平衡的过程中,混合气体平均相对分子质量减小
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下表为元素周期表的一部分,参照元素①~⑦在表中的位置,请用化学用语回答下列
问题:
(1)④、⑤、⑦的原子半径由大到小的顺序为 (用元素符号表示,下同)。
(2)⑥和⑦的最高价含氧酸的酸性强弱为 > 。
(3)①、②两种元素按原子个数之比为1∶1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式 。
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。
①写出D溶液与G反应的化学方程式 。
②写出检验A溶液中溶质的阴离子的方法: 。
③常温下,若电解1 L 0.1 mol/L的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为 mol。
④若上图中各步反应均为恰好完全转化,则混合物X中含有的物质有 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
下图中的每1方格表示一种有关的反应物或生成物。其中A、C为无色气体。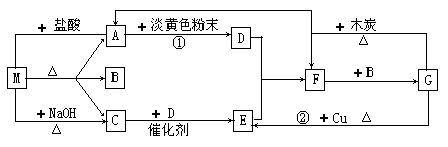
完成下列问题:
(1)物质M可以是 ,F是 。
(2)反应①除生成D外,生成的另一种物质的水溶液显碱性,用离子方程式解释溶液显碱性的原因: 。
(3)检验M中阳离子的方法: 。
(4)G到E的离子反应方程式: ,每生成标况下1.12L的E,转移电子 mol。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在下列各变化中,E为无色无味的液体(常温下),F为淡黄色粉末,G为常见的无色气体(反应条件均已省略)。回答下列问题: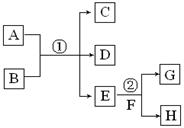
(1) 写出反应②的化学反应方程式 ,在该反应中,每生成2.24LG(标准状况),该反应转移电子的物质的量是 。
(2)若反应①在溶液中进行,A、C、D均含氯元素,且A中氯元素的化合价介于C和D之间。则反应①的化学方程式是 。
(3)若反应①在溶液中进行,A是一种强碱,B是一种酸式盐,D是一种无色的气体,且B遇盐酸产生无色无味的气体。在加热条件下,当A过量时,反应①的离子方程式是 。
(4)若反应①在溶液中进行,A是一种强酸,B是一种含两种金属元素的盐,当A过量时,C及D均易溶于水。则A过量时反应①的离子反应方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、M、N是五种短周期元素,原子序数依次增大。X原子中没有中子,Y元素最高正价与最低负价之和为0;M与X同主族;Z、N分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质(写分子式) ,M离子的电子排布式为 。
由以上某些元素组成的化合物A、B、C、D有如下转化关系
其中C是溶于水显酸性的气体;D是淡黄色固体。
(3)写出C的结构式 ;D的电子式
(4)如果A、B均由三种元素组成,B为两性不溶物,写出由A转化为B的离子方程式
(5)如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因 。
(6)如果将27题中A、B浓度均为0.1mol/L的溶液混合,混合溶液中离子浓度由大到小的顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
化合物A、B、C、D各由两种元素组成,甲、乙、丙是前两周期元素的三种单质。这些常见的化合物与单质之间存在如下关系(已知C是一种有机物),以下结论不正确的是( )
A.甲、乙、丙三种单质均为气态非金属单质
B.上述转化关系所涉及的化合物中有一种是电解质
C.上图所示的五个转化关系中,有三个是化合反应
D.上图所示的五个转化关系中,均为氧化还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com