
【题目】有机物F是合成多种药物的重要中间体,一种合成路线如下:
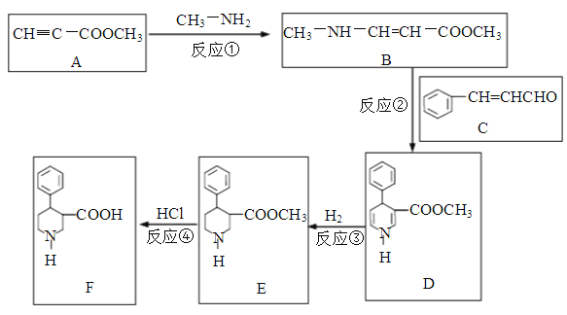
回答下列问题:
(1)写出反应类型。反应①是__________反应,反应④是__________反应。
(2)化合物A中有________种官能团,写出含氧官能团的结构式_____________。
(3)化合物C的俗名是肉桂醛,其分子式是____________。写出肉桂醛跟新制Cu(OH)2在煮沸条件下发生反应的化学方程式______________________。
(4)由肉桂醛( ![]() )和乙酸制备
)和乙酸制备![]() 的合成路线如下:
的合成路线如下:
![]()
请将该合成路线补充完整(无机试剂任选)。________________
(合成路线常用的表示方式为:![]() )
)
【答案】加成 取代 2 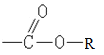 C9H80
C9H80 ![]() +2Cu(OH)2
+2Cu(OH)2![]()
![]() +Cu2O↓+2H2O
+Cu2O↓+2H2O 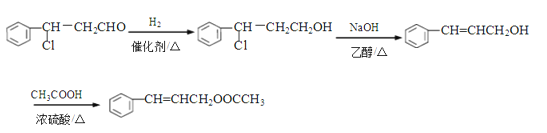
【解析】
比较反应物、生成物的结构,找出反应本质,判断反应类型。设计合成反应途径时,应考虑合理的反应途径、并注意保护官能团等。
(1)比较A、B结构可知,反应①是CH3NH2中一个氨基H与A中C≡C发生加成反应生成B;比较E、F结构可知,反应④是E中酯基水解(取代反应)生成F。
(2)化合物A中有2种官能团:碳碳三键(-C≡C-)、酯基(-COOR),其中酯基含氧元素。
(3)化合物C(肉桂醛)的分子式是C9H80。它跟新制Cu(OH)2煮沸时醛基被氧化成羧基,反应的化学方程式![]() +2Cu(OH)2
+2Cu(OH)2![]()
![]() +Cu2O↓+2H2O。
+Cu2O↓+2H2O。
(4)合成反应第一步已有,为肉桂醛与HCl加成反应生成![]() 。目标产物
。目标产物![]() 可由
可由![]() 与乙酸(CH3COOH)酯化反应生成。故应补充由
与乙酸(CH3COOH)酯化反应生成。故应补充由![]() 合成
合成![]() 的路线,应先与H2加成使-CHO变成-CH2OH,再与强碱醇溶液共热消去HCl。补充流程如下:
的路线,应先与H2加成使-CHO变成-CH2OH,再与强碱醇溶液共热消去HCl。补充流程如下:
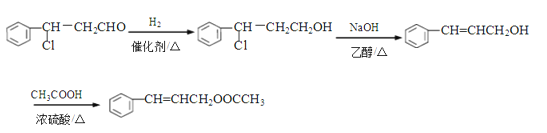


科目:高中化学 来源: 题型:
【题目】工业上用软锰矿(只含MnO2和MnO)、H2SO4(过量)和FeS2制备MnSO4·H2O的流程如下(已知流程中的FeS2、FeSO4、MnO2、MnO均完全反应):
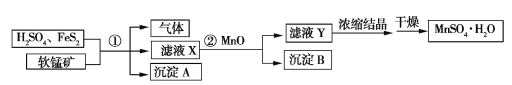
(1)已知①中只有三个反应,其中两个反应是
MnO+H2SO4MnSO4+H2O
FeS2+H2SO4FeSO4+H2S↑+S↓
完成第三个反应:
___MnO2+___FeSO4+___ ____________MnSO4+___ _________+___ _________
(2)沉淀A、B的化学式分别是____________________、__________________。
(3)滤液X中的溶质有__________;实验室中浓缩滤液Y时使用的玻璃仪器有___________________。
(4)若得到的沉淀A的质量和MnSO4·H2O的质量分别为96.0 g、321.1 g,②中加入的MnO为0.1 mol,则理论上软锰矿中MnO2和MnO的物质的量之比为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍具有良好的导磁性和可塑性,主要用于制作合金及催化剂。请回答下列问题
(1)基态镍原子的价电子排布图为____,同周期元素中基态原子与镍具有相同未成对电子的还有____种。
(2)四羰基合镍是一种无色挥发性液体,熔点-25℃,沸点43℃。则四羟基合镍中σ键和π键数目之比为___三种组成元素按电负性由大到小的顺序为____。
(3)[Ni(NH3)
4]SO4中N原子的杂化方式为____,写出与SO42-互为等电子体的一种分子和一种离子的化学式____,____;[Ni(
NH3)4]SO4中H-N-H键之间的夹角___(填“>”“<”或“=”)NH3分子中H-N-H键之间的夹角。
(4)已知NiO的晶体结构(如图1),可描述为:氧原子位于面心和顶点,氧原子可形成正八面体空隙和正四面体空隙,镍原子填充在氧原子形成的空隙中,则NiO晶体中原子填充在氧原子形成的____体空隙中,其空隙的填充率为____。
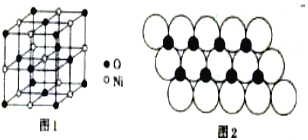
(5)一定温度下,NiO晶体可分散形成“单分子层”,O2-作单层密置排列,Ni2+填充O2-形成的正三角形空隙中(如图2),已知O2-的半径为αm,每平方米面积上分数的NiO的质量为___g。(用a、NA表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用除去表面氧化膜的细铝条紧紧缠绕在温度计上(如图),将少许硝酸汞溶液滴到铝条表面,置于空气中,很快铝条表面产生“白毛”,且温度明显上升。下列分析错误的是

A.Al和O2化合放出热量B.硝酸汞是催化剂
C.涉及了:2Al+3Hg2+→2Al3++3HgD.“白毛”是氧化铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,对于可逆反应X(g)+3Y(g)![]() 2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol·L-1、0.3mol·L-1、0.08mol·L-1,则下列判断正确的是( )
2Z(g),若X、Y、Z的起始浓度分别为c1、c2、c3(均不为零),达到平衡时,X、Y、Z的浓度分别为0.1mol·L-1、0.3mol·L-1、0.08mol·L-1,则下列判断正确的是( )
A. c1∶c2=3∶1
B. X、Y的转化率不相等
C. 平衡时,Y和Z的生成速率之比为2∶3
D. c1的取值范围为0 mol·L-1<c1<0.14 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定某硬铝(含有铝、镁、铜)中铝的含量,设计了Ⅰ、Ⅱ两个方案。根据方案Ⅰ、Ⅱ回答问题:
方案Ⅰ:
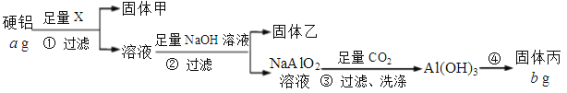
(1)固体甲是铜,试剂X的名称是_______________。
(2)能确认NaOH溶液过量的是___________(选填选项)。
a. 测溶液pH,呈碱性
b. 取样,继续滴加NaOH溶液,不再有沉淀生成
c. 继续加NaOH溶液,沉淀不再有变化
(3)步骤④的具体操作是:灼烧、_______、________,重复上述步骤至恒重。
(4)固体丙的化学式是______,该硬铝中铝的质量分数为_______________。
方案Ⅱ的装置如图所示:
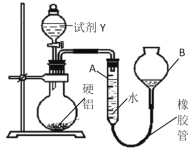
操作步骤有:
①记录A的液面位置;
②待烧瓶中不再有气体产生并恢复至室温后,使A和B液面相平;
③再次记录A的液面位置;
④将一定量Y(足量)加入烧瓶中;
⑤检验气密性,将a g硬铝和水装入仪器中,连接好装置。
(1)试剂Y是________________;操作顺序是______________________。
(2)硬铝质量为a g,若不测气体的体积,改测另一物理量也能计算出铝的质量分数,需要测定的是_______,操作的方法是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】火山爆发产生的气体中含有少量的羰基硫(分子式是:COS),已知羰基硫分子结构与CO2类似,有关说法正确的是( )
A.羰基硫是电解质
B.羰基硫分子的电子式为:![]()
C.C、O、S三个原子中半径最小的是C
D.羰基硫分子为非极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将水分解制得氢气的一种工业方法是“硫﹣碘循环法”,依次涉及下列三步反应:
I.SO2+2H2O+I2=H2SO4+2HI
II.2HI(g)H2(g)+I2(g)
III.2H2SO4=2SO2+O2+2H2O
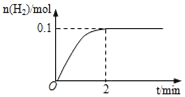
(1)一定温度下,向5L恒容密闭容器中加入1molHI,发生反应II,H2物质的量随时间的变化如图所示。0~2min内的平均反应速率v(HI)=___。相同温度下,若起始加入的HI改为2mol,反应达平衡时H2的量为___mol。
(2)分析上述反应,下列判断错误的是___(填写选项编号,只有一个正确选项)。
a.三步反应均为氧化还原反应
b.循环过程中产生1molH2,同时产生1molO2
c.在整个分解水的过程中SO2和I2相当于催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和H2在一定条件下可以合成乙醇:2CO(g)+4H2(g)![]() CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到最大限度的是( )
CH3CH2OH(g)+H2O(g),下列叙述中能说明上述反应在一定条件下已达到最大限度的是( )
A.CO全部转化为乙醇B.正反应和逆反应的化学反应速率均为0
C.CO和H2以1∶2的物质的量之比反应生成乙醇D.反应体系中乙醇的物质的量浓度不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com