
����Ŀ��ijͬѧ���ʵ��̽����ҵ����ϩ��ԭ������ϩ����Ҫ��ѧ���ʣ�ʵ��װ����ͼ��ʾ(��֪�������Ӧ)����ش��������⣺

��1����ҵ����ϩ��ʵ��ԭ��������(Һ̬)�ڴ����ͼ��������·�����Ӧ���ɲ������������磬ʯ�ͷ������֮һ��ʮ������������Ӧ��C16H34![]() C8H18���ף���
C8H18���ף���![]() 4�ң���ķ���ʽΪ________���ҵĽṹ��ʽΪ____________________________________��
4�ң���ķ���ʽΪ________���ҵĽṹ��ʽΪ____________________________________��
��2��Bװ���е�ʵ�����������________��д����Ӧ�Ļ�ѧ����ʽ��__________���䷴Ӧ������________��
��3��Cװ���пɹ۲쵽��������____________����Ӧ������________��
��4����������֪����ϩ�����Ը��������Һ��Ӧ����������̼�����ݱ�ʵ����װ��_____(����ĸ)�е�ʵ��������жϸ������Ƿ���ʵ��Ϊ��̽��������ϩ��Ӧ�Ǽӳɷ�Ӧ������ȡ����Ӧ�����Բⶨװ��B����Һ�ڷ�Ӧǰ�������ԣ����������ɣ� __________________��
��5��ͨ������ʵ��̽��������������ϩ�ķ�����________(ѡ����ĸ����ͬ)����ȥ��������ϩ�ķ�����________��
A������ͨ��ˮ�� B������ͨ��ʢ��ˮ��ϴ��ƿ
C������ͨ��ʢ���Ը��������Һ��ϴ��ƿ D������ͨ������������Һ
��6���ֱ�ȼ����ϩ�ͼ��飬���������������ϩ�����������̣�ԭ����_________________��
���𰸡� C8H16 CH2===CH2 ��ɫ(��Ȼ�ɫ)��ȥ CH2===CH2��Br2�D��BrCH2��CH2Br �ӳɷ�Ӧ ��ɫ(���Ϻ�ɫ)��ȥ ������Ӧ D ����ϩ���巢��ȡ����Ӧ����HBr������Һ���Ի�������ǿ BC B ��ϩ��̼����������Ϊ85.7%�����ڼ�����̼����������(75%)
��������̽����ҵ����ϩ��ԭ������ϩ����Ҫ��ѧ���ʣ���ʵ��װ�ÿ�֪��A�������ڴ����ͼ��������·�����Ӧ���ɲ���������B����ϩ����ˮ�����ӳɷ�Ӧ��C����ϩ�������ط���������Ӧ��D������C�����ɵĶ�����̼��E��������ˮ���ռ���ϩ��
��1����C16H34![]() C8H18+�ף���
C8H18+�ף���![]() 4�Ҽ�ԭ���غ��֪��ΪC8H16����ΪCH2�TCH2���ʴ�Ϊ��C8H16��CH2�TCH2����2��Bװ���е�ʵ����������dz�ɫ����Ȼ�ɫ����ȥ����Ӧ�Ļ�ѧ����ʽΪCH2�TCH2+Br2��BrCH2-CH2Br���䷴Ӧ�����Ǽӳɷ�Ӧ����3��Cװ���пɹ۲쵽����������ɫ�����Ϻ�ɫ����ȥ����Ӧ������������Ӧ����4����������֪����ϩ�����Ը��������Һ��Ӧ����������̼�����ݱ�ʵ����װ��D�е�ʵ������ʯ��ˮ����ǣ����жϸ������Ƿ���ʵ��Ϊ��̽��������ϩ��Ӧ�Ǽӳɷ�Ӧ������ȡ����Ӧ�����Բⶨװ��B����Һ�ڷ�Ӧǰ�������ԣ�����������Ϊ����ϩ���巢��ȡ����Ӧ����HBr������Һ���Ի�������ǿ����5��A������ͨ��ˮ�У����߾���ˮ����Ӧ�����ܳ��ӣ�Ҳ���ܼ���B������ͨ��ʢ��ˮ��ϴ��ƿ����ϩ����ˮ��Ӧ�������鲻�ܣ��ɼ���Ҳ�ɳ�ȥ�����е���ϩ��C������ͨ��ʢ���Ը��������Һ��ϴ��ƿ����ϩ�������ط�Ӧ�������鲻�ܣ��ɼ��𣬵���Ӧ���ɶ�����̼�����������ʣ����ܳ��ӣ�D������ͨ������������Һ�����߾�����Ӧ�����ܳ��ӣ�Ҳ���ܼ������ʴ�Ϊ��BC��B����6���ֱ�ȼ����ϩ�ͼ��飬���������������ϩ�����������̣�ԭ������ϩ��̼����������Ϊ85.7%�����ڼ�����̼����������(75%)��
4�Ҽ�ԭ���غ��֪��ΪC8H16����ΪCH2�TCH2���ʴ�Ϊ��C8H16��CH2�TCH2����2��Bװ���е�ʵ����������dz�ɫ����Ȼ�ɫ����ȥ����Ӧ�Ļ�ѧ����ʽΪCH2�TCH2+Br2��BrCH2-CH2Br���䷴Ӧ�����Ǽӳɷ�Ӧ����3��Cװ���пɹ۲쵽����������ɫ�����Ϻ�ɫ����ȥ����Ӧ������������Ӧ����4����������֪����ϩ�����Ը��������Һ��Ӧ����������̼�����ݱ�ʵ����װ��D�е�ʵ������ʯ��ˮ����ǣ����жϸ������Ƿ���ʵ��Ϊ��̽��������ϩ��Ӧ�Ǽӳɷ�Ӧ������ȡ����Ӧ�����Բⶨװ��B����Һ�ڷ�Ӧǰ�������ԣ�����������Ϊ����ϩ���巢��ȡ����Ӧ����HBr������Һ���Ի�������ǿ����5��A������ͨ��ˮ�У����߾���ˮ����Ӧ�����ܳ��ӣ�Ҳ���ܼ���B������ͨ��ʢ��ˮ��ϴ��ƿ����ϩ����ˮ��Ӧ�������鲻�ܣ��ɼ���Ҳ�ɳ�ȥ�����е���ϩ��C������ͨ��ʢ���Ը��������Һ��ϴ��ƿ����ϩ�������ط�Ӧ�������鲻�ܣ��ɼ��𣬵���Ӧ���ɶ�����̼�����������ʣ����ܳ��ӣ�D������ͨ������������Һ�����߾�����Ӧ�����ܳ��ӣ�Ҳ���ܼ������ʴ�Ϊ��BC��B����6���ֱ�ȼ����ϩ�ͼ��飬���������������ϩ�����������̣�ԭ������ϩ��̼����������Ϊ85.7%�����ڼ�����̼����������(75%)��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��C��H��N�����ֻ�ѧԪ�����������Ļ�ѧ�ɷ��У�����������ռ73%���ң���������Ԫ������ʯȦ����������������1%�������ʵ˵���ˣ� ��
A. ����������������ͳһ��
B. �������������������
C. Ԫ������Ȼ���ж������ҵ�
D. ��������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������彡����ɽϴ�Σ�����ǣ� ��
A.����ˮ��ͨ������Cl2��������ɱ��
B.��ʳ����ϴ��ˮƿ���ڱڸ��ŵ�ˮ��
C.��SO2Ư��ʳƷ
D.��С�մ�����������ͷ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ������CuS��Cu2S�Ļ����Ͷ��������HNO3�У��ռ�������V L����״��������Ӧ�����Һ�У�����Cu2+��SO42������������NaOH��������ɫ���������ˣ�ϴ�ӣ����գ��õ�CuO 12.0g������������ΪNO��NO2�Ļ����������Ϊ1��1����V����Ϊ��������
A.7.5 L
B.12.3 L
C.15.7 L
D.16.8 L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ�ϳɰ��ķ�Ӧ��N2(g)��3H2(g) ![]() 2NH3��g����һ�����淴Ӧ����Ӧ�����Ǹ��¡���ѹ��������Ҫ���ʵĴ�������֪�γ�1mol H��H����1mol N��H����1mol N
2NH3��g����һ�����淴Ӧ����Ӧ�����Ǹ��¡���ѹ��������Ҫ���ʵĴ�������֪�γ�1mol H��H����1mol N��H����1mol N![]() N���ų��������ֱ�Ϊ436KJ��391KJ��946KJ����
N���ų��������ֱ�Ϊ436KJ��391KJ��946KJ����
(1)��1mol N2��ȫ��Ӧ����NH3��______������ա��ų�������_____KJ��
(2)�����1mol N2 �� 3mol H2��ϣ���һ��������ʹ���ַ�Ӧ����Ӧ�ų���������С��������ֵ����ԭ����_____________________________________________________��
(3)ʵ����ģ�ҵ�ϳɰ�ʱ�����ݻ�Ϊ2L���ܱ������н��У���Ӧ����10min������10mol NH3������N2��ʾ�Ļ�ѧ��Ӧ������________mol��L ��1��min��1��
(4)һ�������£����ɺϳɰ���Ӧ�ﵽ��ѧƽ��ʱ������˵����ȷ������____��
a.����Ӧ���ʺ��淴Ӧ�������
b.����Ӧ��������淴Ӧ����Ϊ0
c.N2��ת���ʴﵽ���ֵ
d. N2��H2��Ũ�����
e.N2��H2��NH3������������
f.��Ӧ�ﵽ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�����������˵����ȷ������ ��
A. ��ͬ������SO2��SO3������ԭ�ӵĸ�����Ϊ1��1
B. �����£�2.7 g�������������ᷴӦ��ʧȥ�ĵ�����Ϊ0.3NA
C. 0.5 mol O3��11.2 L O2�����ķ�����һ�����
D. ��49 g H2SO4����1 Lˮ�У�������Һ�����ʵ���Ũ��Ϊ0.5 molL-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���۶������Ҷ�������PES����һ������ɽ���ľ������������ϱ�Ĥ��ʳƷ��װ��������Ϸ������Ź㷺��Ӧ�ã���ṹ��ʽΪ�� 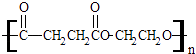 �پ۶������Ҷ�������PES���������ֵ���ͨ����Ӧ���Ӧ���ͣ��Ƶõģ��γɸþۺ�������ֵ����� ��
�پ۶������Ҷ�������PES���������ֵ���ͨ����Ӧ���Ӧ���ͣ��Ƶõģ��γɸþۺ�������ֵ����� ��
�������ֵ����֮��Ҳ�����γ�һ�ְ�Ԫ��״������д���û�״������Ľṹ��ʽ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��2015��2�������о���Ա��CO��O������һ���ɴ������棬�ü������彫����ȵ�2000K���ɹ��۲쵽CO��O�γɻ�ѧ������CO2��ȫ���̣�����˵����ȷ���ǣ������� 
A.CO��CO2����������������
B.�γɻ�ѧ��ʱ����������
C.�ɴ������Ըı�÷�Ӧ���ʱ�
D.CO��O�γɻ�ѧ���������е���ת��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����V L Al2(SO4)3��Һ�м��������ˮ�����˵ó�����Ȼ���ڸ��������ճ������ð�ɫ����m g������ԭ��Һ˵����ȷ���� ( )
A. Al3+�����ʵ���Ũ��Ϊ![]() B. ���ʵ����ʵ���Ũ��
B. ���ʵ����ʵ���Ũ��![]()
C. Al3+�����ʵ���![]() D. SO42-�����ʵ���Ũ��
D. SO42-�����ʵ���Ũ��![]()
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com