
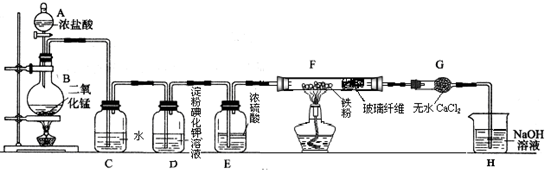
���� A�е�Ũ������B�еĶ��������ڼ��������·�Ӧ��������������ͨ��Cˮ������HCl��HClO����������D����KI��Ӧ���ɵ��ʵ⣬�ٽ���Eͨ��Ũ��������F����Fe��Ӧ�����Ȼ�����G�и�������Է�ֹH�е�ˮ��������F�У����H��NaOH��Һ�������ն����������
��1������������״˵�������ƣ�
��2������ͨ��Cˮ������HCl��HClO������HCl��HClO�ĵ��������
��3����������ǿ�������ԣ��ܹ������⻯�����ɵ��ʵ⣻���ɵ��Ȼ����������ܣ�
��4����ȡ�������к���ˮ������Ҫ�õ�����������Ӧ��ȥ�����е�ˮ������
��5�������ж���Ҫ����β���������������������Ʒ�Ӧ�����Ȼ��ơ��������ƺ�ˮ��
��� �⣺��1������������״��֪��װ��Aʢ��Ũ�����Ϊ��Һ©����
�ʴ�Ϊ����Һ©����
��2������ͨ��Cˮ������HCl��HClO���䷴Ӧ�ķ���ʽΪ��Cl2+H2O=HCl+HClO��HCl����Һ����ȫ�����H+��Cl-��HClO����Һ�в��ֵ����H+��ClO-��������ˮ�к��е���ΪCl2��HClO��H+��Cl-��ClO-��
�ʴ�Ϊ��Cl2+H2O=HCl+HClO��C��
��3����������ǿ�������ԣ��ܹ������⻯�����ɵ��ʵ⣬��Ӧ����ʽ��Cl2+2KI=I2+2KCl�����������۱�����
�ʴ�Ϊ��Cl2+2KI=I2+2KCl��
��3����ȡ�������к���ˮ������Fe������������Ӧ��Ҫ�õ�����������Ӧ��ȥ�����е�ˮ������Ũ���������ˮ�ԣ��ܹ��������������ɵ��Ȼ����������ܣ�˫ͨ��F�мӲ�����ά���Է�ֹ�Ȼ����������ĵ��ܣ����ܶ�����
�ʴ�Ϊ��������������ֹ�Ȼ�����������ĵ��ܣ�
��4�������ж���Ҫ����β��������������������Һ���գ��������������Ʒ�Ӧ�����Ȼ��ơ��������ƺ�ˮ����ѧ����ʽ��Cl2+2NaOH=NaCl+NaClO+H2O��
�ʴ�Ϊ������β���е�������Cl2+2NaOH=NaCl+NaClO+H2O��
���� ���⿼����������ʵ�����Ʊ������ʼ��飬��Ϥ�����Ʊ�ԭ���������Ļ�ѧ�����ǽ���ؼ�����Ŀ�Ѷ��еȣ������ڿ���ѧ���ķ���������ʵ��̽�������ͶԻ���֪ʶ��Ӧ��������


 ͬ��������ϰϵ�д�
ͬ��������ϰϵ�д� �ο�ͨ�γ̱�˼ά����������ѵ��ϵ�д�
�ο�ͨ�γ̱�˼ά����������ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
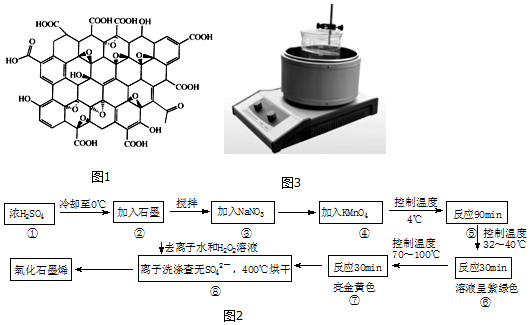
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ɱ���Һ̬�Ȼ��ⶼ�ǵ���� | |
| B�� | �����Ƿ���ж����ЧӦ������ɢϵ��Ϊ��Һ����Һ�ͽ��� | |
| C�� | NaOH�����мȺ������Ӽ��ֺ��й��ۼ� | |
| D�� | Na2O��Fe2O3��Al2O3�����ڼ�����������������ӻ����� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ��ƶ���
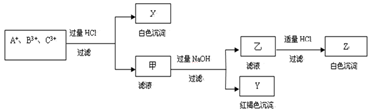
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �ߴ��ȵĹ赥�ʹ㷺�����������ά�����ά��ǿ��ᡰ��·�� | |
| B�� | �ҹ���Ʒ�ӹ�IV������������V���ͣ������ڼ������ꡢ��������߿������� | |
| C�� | �����������Լ�ǿ�ĵ���ɫ���壬����������ˮ�������� | |
| D�� | ��ѧ�ҷ���һ����ϸ����DNA�������飨As��Ԫ�أ���AsԪ�����п���ȡ����ͨDNA���е�PԪ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ʵ����
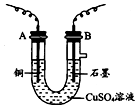 ij��ѧ��ȤС������ͼװ�õ��CuSO4��Һ���ⶨͭ�����ԭ��������
ij��ѧ��ȤС������ͼװ�õ��CuSO4��Һ���ⶨͭ�����ԭ���������鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ũ�Ⱦ�Ϊ0.2 mol•L-1��AgNO3��Һ��CH3COONa��Һ��������һ������CH3COOAg���� | |
| B�� | ��0.001 mol•L-1��AgNO3��Һ����0.001 mol•L-1��KCl��0.001 mol•L-1��K2CrO4�Ļ����Һ�У��Ȳ���Ag2CrO4���� | |
| C�� | c��Mg2+��Ϊ0.11 mol•L-1����Һ��Ҫ����Mg��OH��2��������Һ��pHҪ������9���� | |
| D�� | �������������������£���AgClˮ��Һ�м���NaCl��Һ��Ksp��AgCl������ |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com