
【题目】下列说法不正确的是()
A. 用广范pH试纸测得某溶液的pH为0
B. 可用铁粉鉴别浓硫酸和稀硫酸
C. 蒸馏是分离液态混合物的一种常用方法,广泛应用于石油工业
D. 品红溶液可用于鉴别SO2和CO2
科目:高中化学 来源: 题型:
【题目】已知:A、B、C、D、E、F、G七种元素的核电荷数依次增大,属于元素周期表中前四周期的元素。其中A原子在基态时p轨道半充满且电负性是同族元素中最大的;D、E原子核外的M层中均有两个未成对电子;G原子核外最外层电子数与B相同,其余各层均充满。B、E两元素组成化合物B2E的晶体为离子晶体。C、F的原子均有三个能层,C原子的第一至第四电离能(kJ/mol)分别为:578、1817、2745、ll575;C与F能形成原子数目比为1:3、熔点为190℃的化合物Q。
(1)B的单质晶体为体心立方堆积模型,其配位数为 ;E元素的最高价氧化物分子的立体构型是 。F元素原子的核外电子排布式是 ,F的高价离子与A的简单氢化物形成的配离子的化学式为 .
(2)试比较B、D分别与F形成的化合物的熔点高低并说明理由 。
(3)A、G形成某种化合物的晶胞结构如图所示 。若阿伏伽德罗常数为NA,该化合物晶体的密度为 a g/cm3,其晶胞的边长为 cm。
。若阿伏伽德罗常数为NA,该化合物晶体的密度为 a g/cm3,其晶胞的边长为 cm。
(4)在1.0l×105Pa、t1℃时,气体摩尔体积为53.4 L/mol,实验测得Q的气态密度为5.00g/L,则此时Q的组成为(写化学式) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子能在溶液中大量共存的是
A. K+、Cu2+、NH4+、OH- B. Na+、SO42-、K+、Cl-
C. Na+、H+、Fe2+、NO3- D. Ba2+、Na+、OH-、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,则下列叙述中正确的是 ( )
A. 6.02×1022个H2SO4分子在水中可电离生成2NA个H+
B. 在0℃、101 kPa时,22.4 L氢气中含有NA个氢原子
C. 14 g氮气中含有7NA个电子
D. NA个一氧化碳分子和0.5 mol甲烷的质量比为7∶4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有以下几种措施:
①对燃烧煤时产生的尾气进行除硫处理;②少用原煤作燃料;③燃煤时鼓入足量空气;④开发清洁能源。其中能减少酸雨产生的措施是
A.①②③ B.②③④ C.①②④ D.①③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【淄博市2017届仿真模拟(打靶卷)】CO常用于工业冶炼金属。在不同温度下CO还原四种金属氧化物达平衡后气体中lg![]() 与温度(t)的关系曲线如右图。下列说法正确的是
与温度(t)的关系曲线如右图。下列说法正确的是
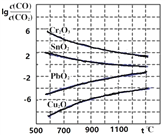
A.通过增高反应炉的高度,延长矿石和CO接触的时间,能减少尾气中CO的含量
B.CO不适宜用于工业冶炼金属Cr
C.CO还原PbO2的反应ΔH>0
D.工业冶炼金属Cu时,高温有利于提高CO的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备氯气(Cl2)的化学方程式如下:4HCl(浓) + MnO2 ![]() MnCl2 + Cl2↑ +2 H2O
MnCl2 + Cl2↑ +2 H2O
(1)用单线桥表示出电子转移的方向和数目________________________,
(2)将题干中反应改写成离子方程式是___________________________。
(3)在上述过程中,被氧化的元素是_________,还原产物是___________,氧化剂和还原剂的物质的量之比为:__________;该反应中盐酸体现的性质为:__________________
(4)若反应中产生0.5 molCl2,则转移的电子数目为_____,被氧化的HCl的物质的量___mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.写出下列反应的离子方程式:
(1)将鸡蛋壳在醋酸中溶解有气泡产生:______________________________________;
(2)CuSO4溶液与Ba(OH)2溶液混合:________________________________________。
(3)铁片插入硝酸银溶液中:_________________________________________________。
Ⅱ.对一份稀溶液作初步分析后发现,溶液无色、澄清,其可能含有![]() 、Na+、
、Na+、![]() 、H+、
、H+、![]() 、
、![]() 、Cl等离子中的若干种。然后又作了如下分析,以确定这些离子是否存在。
、Cl等离子中的若干种。然后又作了如下分析,以确定这些离子是否存在。
①用石蕊试液检测该溶液时,溶液显红色。
②取2 mL溶液用BaCl2溶液和稀硝酸进行检验,结果生成了白色沉淀。
③对②中所得的混合物充分静置后,取其上层澄清的液体用AgNO3溶液和稀硝酸进行检验,结果又生成了白色沉淀。
请回答下列问题:
(1)原溶液中一定存在的离子是__________,一定不存在的离子是____________。
(2)在上述实验操作中,有错误的步骤是_________(填代号)。对该错误改正的方法是(要作较详细的说明)_________________________________________________________。
(3)到目前为止,不能肯定在原溶液中是否存在的离子是____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com