
【题目】实验室制备氯气(Cl2)的化学方程式如下:4HCl(浓) + MnO2 ![]() MnCl2 + Cl2↑ +2 H2O
MnCl2 + Cl2↑ +2 H2O
(1)用单线桥表示出电子转移的方向和数目________________________,
(2)将题干中反应改写成离子方程式是___________________________。
(3)在上述过程中,被氧化的元素是_________,还原产物是___________,氧化剂和还原剂的物质的量之比为:__________;该反应中盐酸体现的性质为:__________________
(4)若反应中产生0.5 molCl2,则转移的电子数目为_____,被氧化的HCl的物质的量___mol
【答案】 ![]() 4H++2Cl- +MnO2
4H++2Cl- +MnO2![]() Mn2++ Cl2↑ +2 H2O Cl MnCl2 1:2 酸性和还原性 6.02
Mn2++ Cl2↑ +2 H2O Cl MnCl2 1:2 酸性和还原性 6.02![]() 1023 1
1023 1
【解析】试题分析:本题考查氧化还原反应的分析和计算,离子方程式的书写。
(1)反应中Cl元素的化合价由HCl中的-1价升至Cl2中的0价,Mn元素的化合价由MnO2中+4价降至MnCl2中的+2价,用单线桥表示为:![]() 。
。
(2)反应中浓盐酸、MnCl2改成离子,其余以化学式保留,反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
(3)在上述过程中,被氧化的元素是Cl;还原产物为MnCl2;在反应中4molHCl参加反应,只有2molHCl被氧化,则氧化剂(MnO2)和还原剂(HCl)物质的量之比为1:2;在反应中盐酸表现还原性和酸性。
(4)根据上述分析,产生1molCl2转移2mol电子,产生0.5molCl2,转移1mol电子,转移电子数为6.02![]() 1023个。被氧化的HCl物质的量为1mol。
1023个。被氧化的HCl物质的量为1mol。


科目:高中化学 来源: 题型:
【题目】某研究性学习小组欲测定室温下(25℃、101 kPa)的气体摩尔体积,请回答以下问题。该小组设计的简易实验装置如图所示:

该实验的主要操作步骤如下:
(1)配制80 mL 1.0 mol·L-1的硫酸溶液:
①通过计算,需用量筒量取18mol/L的浓硫酸的体积为__________mL。
②在配置稀硫酸的过程中,所需要的实验仪器有:烧杯、量筒、玻璃棒、__________、________。
③下列操作能造成所配溶液的物质的量浓度偏大的是________。
A.转移溶液时不慎有少量液体洒在容量瓶外面
B.转移前,容量瓶中有少量蒸馏水
C.定容时,眼睛俯视刻度线
D.定容后,上下摇匀后液面下降,补充少量水
(2)用量筒量取25.0mL 1.0 mol·L-1的硫酸溶液加入锥形瓶中;并称取a g己除去表面氧化膜的镁条,并系于铜丝末端,为使H2SO4全部参加反应,a的数值至少为__________;
(3)往广口瓶中装入足量水,按上图连接好装置,检查装置的气密性;反应结束后待体系温度恢复到室温,读出量筒中水的体积为VmL。读数时除恢复至室温外,还要注意:___________________,且该步骤应选用______________(填序号)的量筒。
A.100mL B.200 mL C.500 mL D.1000mL
(4)若忽略水蒸气的影响,在实验条件下测得气体摩尔体积的计算式为Vm=____________(用V表示),若未除去镁条表面的氧化膜,则测量结果____________。(题“偏大”、“ 偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是()
A. 用广范pH试纸测得某溶液的pH为0
B. 可用铁粉鉴别浓硫酸和稀硫酸
C. 蒸馏是分离液态混合物的一种常用方法,广泛应用于石油工业
D. 品红溶液可用于鉴别SO2和CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.在常温常压下,1 mol氦气含有的原子数为NA
B.标准状况下,5.6 L四氯化碳含有的分子数为0.25NA
C.常温常压下,氧气和臭氧(O3)的混合物32 g中含有NA个氧原子
D.物质的量浓度为1 mol·L-1的K2SO4溶液中,含2 NA个K+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是 ( )
A. H2SO4+2NaOH=Na2SO4+2H2O B. CuO+H2![]() Cu+ H2O
Cu+ H2O
C. NH3+HCl=NH4Cl D. 2NaHCO3![]() Na2CO3+ H2O +CO2↑
Na2CO3+ H2O +CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知铜的配合物A(结构如图)。请回答下列问题:
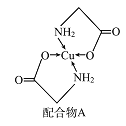


(1)Cu的简化电子排布式为______________ 。
(2)A所含三种元素C、N、O的第一电离能由大到小的顺序为_______________。其中氮原子的杂化轨道类型为________。
(3)配体氨基乙酸根(H2NCH2COO-)受热分解可产生CO2和N2,N2中σ键和π键数目之比
是__________;N2O与CO2互为等电子体,且N2O分子中O只与一个N相连,则N2O的电子式为_______。
(4)在Cu催化下,甲醇可被氧化为甲醛(HCHO),甲醛分子中H CO的键角___________(选填“大于”、“等于”或“小于”)120°;甲醛能与水形成氢键,请在右图中表示出来___________。
(5)立方氮化硼(如图)与金刚石结构相似,是超硬材料。立方氮化硼晶体内B-N键数与硼原子数之比为___________;结构化学上用原子坐标参数表示晶胞内部各原子的相对位置,上图(右)立方氮化硼的晶胞中,B原子的坐标参数分别有:
![]() 等。则距离上述三个B原子最近且等距的N原子的坐标参数为____________________ 。
等。则距离上述三个B原子最近且等距的N原子的坐标参数为____________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,回答下列问题:
(1)现有下列物质;①熔融的NaCl ②液态HCl ③蔗糖 ④汞 ⑤NaOH溶液 ⑥稀硫酸 ⑦CO2 ⑧KCl晶体
其中属于电解质的是__________;属于非电解质的是__________;能导电的有__________。
(2)按要求填空。
①NaHSO4溶液(写出电离方程式)____________________________。
②氯水与KI溶液反应(写出离子方程式)_____________________________。
③苏打和澄清石灰水反应(写出离子方程式)_______________________________
(3)配平下列氧化还原方程式:
①_____Fe+_____HNO3 = _____Fe(NO3)3+_____NO↑+_____H2O
②____CO+____ Fe2O3 ![]() ____Fe+_____CO2
____Fe+_____CO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列几种物质:A、金刚石和石墨 B、C2H6和C5H12 C、12C和14C D、正丁烷和异戊烷 E、葡萄糖和果糖 F、红磷和白磷G、NH4CNO与尿素(CO(NH2)2) H、35Cl和37Cl I、 J、
J、
(1)属于同分异构体的是 ____________(填序号,下同);
(2)属于同素异形体的是__________(3)属于同系物的是___________
(4)属于同位素的是______________(5)属于同一种物质的是___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com