
����Ŀ����ͼΪ����0.2molL��1Na2CO3��Һ250mLʾ��ͼ��

�ش��������⣺
��1�����гƵ�Na2CO3 g��
��2���������������������е����÷ֱ��� �� ��
��3�������������������������ҺŨ���к�Ӱ�죿������ƫ��������ƫ����������Ӱ������
A��ijͬѧ�ڵ������۲�Һ��ʱ���� ��
B��û�н��в������������� ��
C���ڵ���������������Һ����������ƿ�� ��
���𰸡���1��5.3��
��2�����裻������
��3��A��ƫ�ߣ�B��ƫ�ͣ�C��ƫ�ͣ�
�������������������1���������ʵ�����m=nM=cvM���㣻
��2���ܽ����ʱ�����Ǽ����ܽ⣬����ʱ���������ã�
��3���������������ʵ����ʵ��������Һ�������Ӱ�죬����c=![]() ������������Һ��Ũ��Ӱ�죮
������������Һ��Ũ��Ӱ�죮
�⣺��1��0.2molL��1Na2CO3��Һ250mL��ҪNa2CO3������Ϊ��0.25L��0.2mol/L��106g/mol=5.3g���ʴ�Ϊ��5.3��
��2�����������ܽ����ʱΪ�˼����ܽ⣬��������ã�����ʱ�����������ã�
�ʴ�Ϊ�����裻������
��3��A��ijͬѧ�ڵ������۲�Һ��ʱ���ӣ���Һ�����ƫС��������ҺŨ��ƫ�ߣ��ʴ�Ϊ��ƫ�ߣ�
B��û�н��в������������������ʵ�����ƫС��������ҺŨ��ƫ�ͣ��ʴ�Ϊ��ƫ�ͣ�
C���ڵ���������������Һ����������ƿ�⣬���ʵ�����ƫС��������ҺŨ��ƫ�ͣ��ʴ�Ϊ��ƫ�ͣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��������������ȷ���ǣ� ��
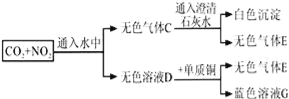
A. C�ijɷ�������E�������̼�Ļ������
B. Ũ�ȵ�D��Һ�ܰ�̼��������Ϊ������̼
C. ����E�������ᱻ�����ɺ���ɫ������
D. ��ҺG����ɫ������ͭ��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������±��и�����Ų����ɣ����˹����Ų���23��ӦΪ
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
C2H6 | C2H4 | C2H4O2 | C3H8 | C3H6 | C3H6O2 | C4H10 | C4H8 | C4H8O2 | C5H12 |
A��C8H18 B��C9H118O2 C��C9H18 D��C8H16O2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A��������ˮ�����ܣ��������ѻ�������ȡ��ˮ�е���
B��ʯ�ͺ�������������������������ú���б����ױ������ױ����л���
C��ú��������Һ����ʹú��������Դ����С������Ⱦ����Ч;��
D���е㷶Χ�����ͣ�ú�ͣ����ͣ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ҵ������и���ѧ����ͼ��ʾ���Ҵ��ڸ��ַ�Ӧ��Ӧ���ѵļ�˵������ȷ���ǣ� ��
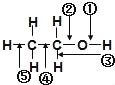
A���ͽ���������ʱ�����ڶ���
B����Ũ���Ṳ����170��ʱ�����ں͢ݶ���
C����HBr����ʱ�����ܶ���
D����ͭ���º�������Ӧʱ�����ٺ͢۶���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������һ�����ʵ���Ũ�ȵ�NaOH��Һʱ�����ʵ����ƫ�͵��ǣ� ��
A. ����ʱ�۲�Һ�温��
B. δ��ȴֱ��ת����Һ
C. ������NaOH��Һ�������ձ���
D. ����ƿ��ԭ������������ˮ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��1���ij��̬����2����Ȼ��ⷢ���ӳɷ�Ӧ�����ܺ�6�����������ȡ����Ӧ���ɴ˿��Զ϶�ԭ��̬���ǣ��������������ͬ�����²ⶨ���� ��
A����Ȳ B����Ȳ C����Ȳ D������ϩ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����Ŵ�����Ⱦ���������أ�����������ʮ�������ڼ䣬����������(SO2)�ŷ������� 8%����������(NOx)�ŷ������� 10%��Ŀǰ������������Ⱦ�ж��ַ�����
��1���� CH4 ����ԭ��������������������������Ⱦ��
��֪����CH4(g) + 4NO2(g) = 4NO(g) + CO2(g) + 2H2O(g)��H =��574 kJ/mol
��CH4(g) + 4NO(g) = 2N2(g) + CO2(g) + 2H2O(g)��H =��1160 kJ/mol
��H2O(g) = H2O(l) ��H =��44.0 kJ/mol
д�� CH4(g)�� NO2(g)��Ӧ���� N2(g)��CO2(g)�� H2O(l)���Ȼ�ѧ����ʽ��__________��
��2������ Fe2+��Fe3+�Ĵ������������¿ɽ� SO2 ת��Ϊ SO42-���Ӷ�ʵ�ֶ� SO2 ����������֪�� SO2 �ķ���ͨ�뺬 Fe2+��Fe3+����Һʱ������һ����Ӧ�����ӷ���ʽΪ 4Fe2+ + O2 + 4H+ = 4Fe3+ + 2H2O������һ��Ӧ�� ���ӷ���ʽΪ__________��
��3���û���̿��ԭ��������������йط�ӦΪ C(s) + 2NO(g) ![]() N2(g) + CO2(g)��ij�о�С�����ܱյ���� ������(��������������䣬��������������Բ���)���� NO �������Ļ���̿���ں���(T1��)�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
N2(g) + CO2(g)��ij�о�С�����ܱյ���� ������(��������������䣬��������������Բ���)���� NO �������Ļ���̿���ں���(T1��)�����·�Ӧ����Ӧ���е���ͬʱ���ø����ʵ�Ũ�����£�
Ũ��(mol/L) | NO | N2 | CO2 |
0 | 1.00 | 0 | 0 |
10 | 0.58 | 0.21 | 0.21 |
20 | 0.40 | 0.30 | 0.30 |
30 | 0.40 | 0.30 | 0.30 |
40 | 0.32 | 0.34 | 0.17 |
50 | 0.32 | 0.34 | 0.17 |
��10��20 min ����(N2)��ʾ�ķ�Ӧ����Ϊ__________��
���÷�Ӧ��ƽ�ⳣ������ʽ K=________�����ݱ������ݣ����� T1 ��ʱ�÷�Ӧ��ƽ�ⳣ��Ϊ__________(������λС��)��
��һ���¶��£����� NO ����ʼŨ�������� NO ��ƽ��ת����__________ (
�����и�������Ϊ�жϸ÷�Ӧ�ﵽƽ�����__________ (�����)��
A�����������ܶȱ��ֲ���
B������(NO) = 2����(CO2)
C��������ѹǿ���ֲ���
D�������� N2 ������������ֲ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ijԪ�ص�ԭ�������������Ƴ���Ԫ��ԭ�ӵģ���
A. ������ B. ������ C. ������ D. �˵����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com