
关于下列各实验装置的叙述中,不正确的是( )
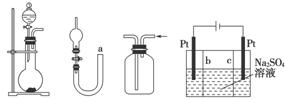
① ② ③ ④
A.图①可用于实验室制取少量NH3或O2
B.可用从a处加水的方法检验图②装置的气密性
C.实验室可用图③的方法收集Cl2或NH3
D.利用图④装置制硫酸和氢氧化钠,其中b为阴离子交换膜,c为阳离子交换膜
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
氯碱厂电解饱和食盐水制取NaOH的工艺流程示意图如下

依据上图,完成下列填空:
(1)在电解过程中,与电源正极相连的电极上所发生反应的化学方程式为 ,与电源负极相连的电极附近,溶液pH (选填“不变”“升高”或“下降”)。
(2)如果粗盐中SO42-含量较高,必须添加钡试剂除去SO42-,该钡试剂可以是 (选填a,b,c多选扣分)。
a.Ba(OH)2 b.Ba(NO3)2 c.BaCl2
(3)为有效除去Ca2+、Mg2+、SO42-,加入试剂的合理顺序为 (选填a、b、c多选扣分)。
a.先加NaOH,后加Na2CO3,再加钡试剂 b.先加NaOH,后加钡试剂,再加Na2CO3
c.先加钡试剂,后加NaOH,再加Na2CO3
(4)在隔膜法电解食盐水时,电解槽分隔为阳极区和阴极区,防止Cl2与NaOH反应;采用无隔膜电解冷的食盐水时,Cl2与NaOH充分接触,产物仅是NaClO和H2,相应的化学方程式为 ___________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是元素周期表的一部分。请回答:
| ① | |||||||||||||||||
| ③ | ④ | ⑤ | ⑥ | ||||||||||||||
| ② | ⑦ | ||||||||||||||||
| ⑧ | |||||||||||||||||
(1)元素③与⑧的元素符号分别为 、 。
(2)元素①②⑥形成的化合物的电子式 。
(3)元素①⑤⑥形成的共价化合物的化学式 。
(4)元素④⑤⑥⑦的第一电离能由大到小的顺序是 (写元素符号)。(5)元素①④形成的δ键与π键个数比为5:1的化合物是 (填名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
化合物A的相对分子质量为150。经李比希法测得其中含C 72.0%、H 6.67%,其余为氧。现代仪器分析有机化合物分子结构有以下两种方法:方法一:核磁共振仪可以测定A有五种化学环境不同的H原子,其个数比为1∶2∶2∶2∶3 。
方法二:利用红外光谱仪可初步检测有机化合物中的某些基团,现测得A分子的红外光谱如下图所示。
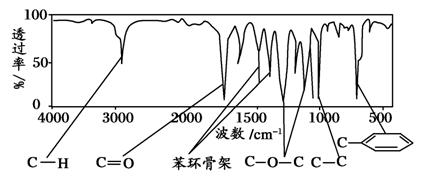
已知:A分子中只含一个苯环,且苯环上只有一个取代基,请回答:
(1)A的分子式为:_______________;
(2)A的结构简式为:_____________;
(3)推测A可能发生下列反应中的_________________;
a 加成 b 取代 c 氧化 d 加聚
(3)A的芳香类同分异构体有多种,请按相应要求写出一种结构简式:
①分子中含有苯环且不含甲基的羧酸:___________________________;
②苯环与羟基直接相连,且苯环上只有两个取代基的醛(含有-CHO):
______________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定温度下,硫酸铜受热分解生成CuO、SO2、SO3和O2。已知:SO2、SO3都能被碱石灰和氢氧化钠溶液吸收。利用如图所示装置加热硫酸铜粉末直至完全分解。若硫酸铜粉末质量为10.0 g,完全分解后,各装置的质量变化关系如表所示。
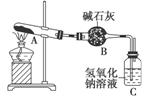
| 装置 | A(试管+粉末) | B | C |
| 反应前 | 42.0 g | 75.0 g | 140.0 g |
| 反应后 | 37.0 g | 79.5 g | 140.0 g |
请通过计算,推断出该实验条件下硫酸铜分解的化学方程式是( )
A.4CuSO4
 4CuO+2SO3↑+2SO2↑+O2↑
4CuO+2SO3↑+2SO2↑+O2↑
B.3CuSO4
 3CuO+SO3↑+2SO2↑+O2↑
3CuO+SO3↑+2SO2↑+O2↑
C.5CuSO4
 5CuO+SO3↑+4SO2↑+2O2↑
5CuO+SO3↑+4SO2↑+2O2↑
D.6CuSO4
 6CuO+4SO3↑+2SO2↑+O2↑
6CuO+4SO3↑+2SO2↑+O2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质的性质和应用正确的是( )
A.在电热水器的钢铁内胆中装入铜棒可以防止内胆被腐蚀
B.二氧化硅具有半导体性能,可以制成光电池
C.二氧化氯(ClO2)和臭氧可用作自来水消毒剂
D.油脂水解可得到氨基酸和甘油
查看答案和解析>>
科目:高中化学 来源: 题型:
下列溶液中有关物质的量浓度关系正确的是( )
A.NaHSO3溶液呈酸性,则有:c(Na+)>c(HSO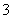 )>c(SO
)>c(SO )>c(H+)>c(OH-)
)>c(H+)>c(OH-)
B.pH相等的CH3COONa和Na2CO3两种溶液:
c(CH3COONa)<c(Na2CO3)
C.强酸HA溶液与弱碱MOH溶液混合后溶液呈中性,则有:c(M+)=c(A-)
D.0.1 mol·L-1的NaHA溶液pH=1,则有:c(Na+)=c(H2A)+c(HA-)+
c(A2-)
查看答案和解析>>
科目:高中化学 来源: 题型:
随着科学技术的发展,阿佛加德罗常数的测定手段越来越多,测定的精度也越来越高。现有一种简单可行的测定方法,具体步骤为:
 ①将NaCl固体细粒干燥后,准确称取m gNaCl固体细粒并转移到定容仪器A中
①将NaCl固体细粒干燥后,准确称取m gNaCl固体细粒并转移到定容仪器A中
②用滴定管向A仪器中加苯,不断振荡,继续加苯到A仪器的刻度,计算出NaCl固体的体积V cm3。
(1)步骤①中仪器A最好使用 (填序号)
A.量筒 B.烧杯 C.容量瓶 D.试管
|
(3)能否用水代替苯 ,理由是 。
(4)已知NaCl晶体中,靠得最近的Na+、Cl—间的距离为a cm(如上图),则用上述方法测得的阿佛加德常数NA的表达式为NA= mol-1。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com