
| A. | 元素A和C能形成AC2型的共价化合物 | |
| B. | B的氧化物能与A的最高价氧化物的水化物反应 | |
| C. | 原子半径:B>A,离子半径:C<D | |
| D. | D的单质有毒,且有漂白性 |
分析 短周期主族元素A、B、C、D的原子序数依次增大,C原子的最外层电子数既是A原子内层电子数的3倍又是B原子最外层电子数的2倍,最外层最多容纳8个电子,则A只能含有2个电子层,A原子内层电子数为2,C最外层含有6个电子,则B最外层含有3个电子,结合A、B、C的原子序数依次增大可知C为S;A、B、C原子的最外层电子数之和为13,则A最外层电子数=13-6-3=4,则A为C元素;B的原子序数大于C元素,则B为Al元素;D的原子序数大于S,且为主族元素,则D为Cl元素,据此进行解答.
解答 解:短周期主族元素A、B、C、D的原子序数依次增大,C原子的最外层电子数既是A原子内层电子数的3倍又是B原子最外层电子数的2倍,最外层最多容纳8个电子,则A只能含有2个电子层,A原子内层电子数为2,C最外层含有6个电子,则B最外层含有3个电子,结合A、B、C的原子序数依次增大可知C为S;A、B、C原子的最外层电子数之和为13,则A最外层电子数=13-6-3=4,则A为C元素;B的原子序数大于C元素,则B为Al元素;D的原子序数大于S,且为主族元素,则D为Cl元素,
根据分析可知:A为C,B为Al,C为S,D为Cl,
A.A为C、C为S,二者可以形成共价化合物CS2,故A正确;
B.B为Al,其氧化物为氧化铝,A为C,其最高价氧化物对应水合物为碳酸,氧化铝溶于强酸,不与弱酸碳酸反应,故B错误;
C.A为C、B为Al,原子半径Al>C;C为S、D为Cl,硫离子与氯离子的电子层数相同,电荷守恒越大,离子半径越小,则离子半径:C>D,故C错误;
D.D为Cl,其单质为氯气,干燥的氯气没有漂白性,故D错误;
故选A.
点评 本题题考查元素的位置结构性质的关系及应用,题目难度中等,推断元素为解答关键,注意根据核外电子关系特点判断元素的种类,试题培养了学生的分析能力及灵活应用能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题

 的系统命名4-甲基-2-乙基-1-戊烯
的系统命名4-甲基-2-乙基-1-戊烯 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
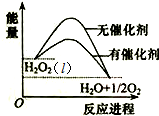
| A. | 加入催化剂,减小了反应的热效应(l) | |
| B. | 加入催化剂,不能提高H2O2的平衡转化率 | |
| C. | H2O2分解的热化学方程式:H2O2(l)═H2O(l)+$\frac{1}{2}$O2 (g)△H>0 | |
| D. | 无法比较反应物的总能量和生成物的总能量的相对大小 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若A2和B2的总能量之和大于生成的AB的总能量,则反应吸热 | |
| B. | 若A2和B2的总能量之和小于生成的AB的总能量,则反应放热 | |
| C. | 若该反应为放热反应,则Q1+Q2<2Q3 | |
| D. | 若该反应为吸热反应,则Q1+Q2<Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 吸热183 kJ | B. | 放热183 kJ | C. | 放热91.5 kJ | D. | 吸热91.5 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O△H=-48.40 kJ/mol | |
| B. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=-5518 kJ/mol | |
| C. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=+5518 kJ/mol | |
| D. | C8H18(l)+$\frac{25}{2}$O2(g)═8CO2(g)+9H2O(l)△H=+48.40 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com