
����Ŀ��Ԫ�ص��ʼ��仯�����й㷺��;����������ڱ��е�������Ԫ�����֪ʶ�ش��������⣺
��1����ԭ������������˳��ϡ��������⣩������˵����ȷ����_______________��
a��ԭ�����������Ӱ뾶����С b�������Լ������ǽ�������ǿ
c���������Ӧ��ˮ������Լ�����������ǿ d�����ʵ��۵㽵��
��2��ԭ�������������������������ͬ��Ԫ������Ϊ___________�������������ļ���������___��
��3����֪��
������ | MgO | Al2O3 | MgCl2 | AlCl3 |
���� | ���ӻ����� | ���ӻ����� | ���ӻ����� | ���ۻ����� |
�۵�/�� | 2800 | 2050 | 714 | 191 |
��ҵ��þʱ�����MgCl2�������MgO��ԭ����___________________________������ʱ�����Al2O3�������AlCl3��ԭ����_________________________________________��
��4������裨�۵�1410���������õİ뵼����ϡ��ɴֹ��ƴ���������£�
![]()
д��SiCl4�ĵ���ʽ��____________����������SiCl4�ƴ���ķ�Ӧ�У����ÿ����1.12kg����������akJ������д���÷�Ӧ���Ȼ�ѧ����ʽ��_______________________________��
��5��P2O5�Ƿ������Ը�������������岻����Ũ����������P2O5�������_______��
a�� NH3b�� HI c�� SO2d �� CO2
��6��KClO3������ʵ������O2�������Ӵ�����400��ʱ�ֽ�ֻ���������Σ�����һ�����������Σ���һ���ε��������Ӹ�����Ϊ1:1��д���÷�Ӧ�Ļ�ѧ����ʽ��____________��
���𰸡�b � Na+�������ӣ� MgO���۵�ߣ�����ʱ�ķѸ�����Դ�����������ɱ� AlCl3�ǹ��ۻ��������̬�ѵ���  SiCl4(g)+2H2(g)
SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g) H=+0.025kJmol1 b
Si(s)+4HCl(g) H=+0.025kJmol1 b ![]()
��������
��1������ͬһ������Ԫ�����������ݽ��н��
��2�����������У�����������Ϊ8��ԭ�������������������������ͬ�����Ԫ��Ϊ벣����������м�������Ϊ�����ӡ�þ���Ӻ������ӣ������Ļ�ԭ��Խǿ����Ӧ���ӵ�������Խ����
��3�����ݱ��н�����������۵�ߵ͡����������ͽ��з�����
��4�����Ȼ���Ϊ���ۻ������ѧʽ�д���4�����ȼ��������������ݼ��Ȼ�ѧ����ʽ����д����д���÷�Ӧ���Ȼ�ѧ����ʽ��
��5��Ũ�������ǿ�����ԡ����ԣ�P2O5�Ƿ������Ը������Ȼ���ϸ�ѡ������������ʽ����жϣ�
��6�����������Ϣ�жϸ���������Ϊ�Ȼ��أ��ٸ��ݻ��ϼ۱仯�ж���һ�������������ƣ������ݻ��ϼ����������ƽ���ɡ�
��1��a��ԭ�Ӱ뾶�����Ӱ뾶����С�����������У�����ԭ�������ĵ�����ԭ�Ӱ뾶��С�������Ӱ뾶��Ҫ�����������ӽ������ۣ�������ֻ��2�����Ӳ㣬���ź˵���������뾶��С������������3�����Ӳ㣬���ź˵������������С�����������Ӱ뾶������������Ӱ뾶���������ӵ������ӣ��뾶�ڼ�С����a����
b�������Լ������ǽ�������ǿ��ͬһ�����У����ź˵�����ĵ�����Ԫ�صĽ������������ǽ���������ǿ����b��ȷ��
c������������Ӧ��ˮ������Լ�����������ǿ����c����
d���������ʵ��۵㽵�ͣ���Na��Mg��Al��Si��ԭ�Ӿ��壩�����ǽ��������Ƿ��Ӿ��壬�۵�Ƚ������ʵͣ�����������Si��Al��Mg��S��Na��P��Cl2��Ar����d����
�ʴ�Ϊ��b��
��2��ԭ�������������������������ͬ�������������д�������Ϊ8����Ԫ��ԭ�ӽṹʾ��ͼΪ��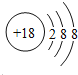 �����Ԫ��Ϊ벣������Ļ�ԭ��Խǿ����Ӧ���ӵ�������Խ�������Ե���������������������ΪNa+��
�����Ԫ��Ϊ벣������Ļ�ԭ��Խǿ����Ӧ���ӵ�������Խ�������Ե���������������������ΪNa+��
�ʴ�Ϊ��벣�Na+��
��3����������þ���۵�ԶԶ�����Ȼ�þ���۵㣬����ʱ���ĸ����������������ɳɱ������Թ�ҵ��þʱ�����õ��MgCl2�������MgO�������Ȼ���Ϊ���ۻ��������״̬���Ȼ����ѵ��磬�ƹ�ʱ���Al2O3�������AlCl3��
�ʴ�Ϊ��MgO���۵�ߣ�����ʱ���ĸ������������������ɱ����Ȼ����ǹ��ۻ��������̬�Ȼ����ѵ��磻
��4�����Ȼ���Ϊ���ۻ������ԭ�Ӻ�ԭ�Ӷ��ﵽ8�����ӣ����Ȼ���ĵ���ʽΪ�� ��1.12kg��������ʵ���Ϊ��
��1.12kg��������ʵ���Ϊ��![]() =40mol������40mol������akJ������������1mol�����յ�����Ϊ��
=40mol������40mol������akJ������������1mol�����յ�����Ϊ��![]() =0.025akJ���������Ȼ���������������Ӧ���ɵ��ʹ���Ȼ�����Ȼ�ѧ����ʽΪ��SiCl4(g)+2H2(g)
=0.025akJ���������Ȼ���������������Ӧ���ɵ��ʹ���Ȼ�����Ȼ�ѧ����ʽΪ��SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g) H= +0.025kJmol-1��
Si(s)+4HCl(g) H= +0.025kJmol-1��
�ʴ�Ϊ�� ��SiCl4(g)+2H2(g)
��SiCl4(g)+2H2(g)![]() Si(s)+4HCl(g) H= +0.025kJmol-1��
Si(s)+4HCl(g) H= +0.025kJmol-1��
��5��Ũ�������ǿ�����ԡ����ԣ����ܸ�����л�ԭ�ԡ����Ե����壬����ѡ���в�����Ũ��������Ϊa��NH3��b��HI����P2O5�Ƿ������Ը���������ܸ���������壬���Ը���⻯�⣬����b��ȷ��
�ʴ�Ϊ��b��
��6��KClO3������ʵ������O2�������Ӵ�����400��ʱ�ֽ�ֻ���������Σ�����һ�����������Σ���һ���ε��������Ӹ�����Ϊ1��1�����������ΪKCl��KCl����Ԫ�ػ��ϼ�Ϊ-1��˵�����������Ԫ�ػ��ϼ۽��ͣ�����һ�ֺ�����������Ԫ�ػ��ϼۻ����ߣ��������������Ԫ�ػ��ϼ�Ϊ+5������Ԫ�ػ��ϼ�����ֻ�ܱ������ɸ�����أ�����������ԭ��Ӧ�л��ϼ����������ƽ�÷�ӦΪ��![]() ��
��
�ʴ�Ϊ��![]() ��
��


 ��1����Ԫ�¿�������ĩϵ�д�
��1����Ԫ�¿�������ĩϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ʵ��װ�û������˵���У���ȷ����(����)



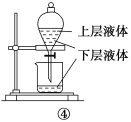
A.�ٿ�����ʵ������MnO2������Ũ���Ṳ�ȣ���ȡ���ռ����������Cl2
B.��ʵ��������������ɫ���ұ�������ɫ������֤�������ԣ�Cl2��Br2��I2
C.��ʵ���Թ��л����ɺ�ɫ����
D.��ͼ�ܲ�������ȡ��ˮ�еĵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ũ�Ⱦ�Ϊ0.1 mol/L�������ΪV0��HX��HY���ֱ��ˮϡ�������V��pH��lg V/V0�ı仯��ϵ����ͼ��ʾ������������ȷ����
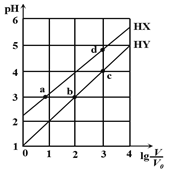
A. a��b�������Һ�У�c��X-����c��Y-��
B. ��ͬ�¶��£����볣��K(HX)��d��a
C. ��Һ��ˮ�ĵĵ���̶ȣ�d��c��b��a
D. lgV/V0=2ʱ����ͬʱ������Һ�壨�����ǻӷ�������c(X-) /c(Y-) ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ֱ����뷴Ӧ����ʽ��Ӧ����ȷ���ǣ� ��
A.ʵ��������ˮ�ͱ��ڴ������������壺![]() +Br2
+Br2![]() +HBr
+HBr
B.��CH2BrCOOH�м�������������������Һ�����ȣ�CH2BrCOOH+OH�C![]() CH2BrCOO�C+H2O
CH2BrCOO�C+H2O
C.ʵ��������Ȳ��Ӧ����ʽ��CaC2+2H2O��Ca(OH)2+C2H2��
D.��������Һ��ͨ������������̼��C6H5O-+CO2+H2O��C6H5OH+CO32-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������±��ش�������������Ϊ�����µ���������
�� | ���볣��(Ka) | �� | ���볣��(Ka) | �� | ���볣��(Ka) | �� | ���볣��(Ka) |
CH3COOH | 1.8��10-5 | H2CO3 | K1=4.4��10-7 K2=4.7��10-11 | H2C2O 4 | K1=5.4��10-2 K2=5.4��10-5 | H2S | K1=1.3��10-7 K2=7.1��10-15 |
HClO | 3��10-8 |
��ش��������⣺
��1��ͬŨ�ȵ�CH3COO-��HCO3-��CO32-��HC2O4-��ClO-��S2-�н��H+��������������__________��
��2��������0.1 molL-1��CH3COOH��Һ�ڼ�ˮϡ�����У����б���ʽ������һ����С����_______�����������
A.c(H+) B. c(H+)/c(CH3COOH) C. c(H+)/c(OH-) D. c(OH-)
��3��0.1 molL-1��H2C2O4��Һ��0.1 molL-1��KOH����Һ�������Ϻ�������Һ�����ԣ�����Һ�и�����Ũ���ɴ�С��˳��Ϊ______________��
��4��pH��ͬ��NaClO��CH3COOK��Һ������Һ�����ʵ���Ũ�ȵĴ�С��ϵ�ǣ�CH3COONa______NaClO������Һ�У�[c(Na+)-c(ClO-)]______[c(K+)-c(CH3COO-)]���������������=������
��5����0.1 molL-1CH3COOH ��Һ�еμ� NaOH ��Һ�� c(CH3COOH): c(CH3COO-)=5 : 9����ʱ��ҺpH=_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£���A��B����������A�Ǻ����ܱ�������B�Ǻ�ѹ�ܱ���������������ʼ״̬��ȫ��ͬ�����ж�����NO2���壬���ֻ���Ƿ������п��淴Ӧ��2NO2![]() N2O4���ֱ�һ��ʱ���A��B����ƽ�⣬�����й�������ȷ����
N2O4���ֱ�һ��ʱ���A��B����ƽ�⣬�����й�������ȷ����
A. ƽ����Ӧ����A��B
B. ƽ��ʱNO2�����ʵ���B��A
C. ƽ��ʱNO2��ת����A��B
D. ƽ��ʱN2O4�����ʵ���B��A
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪H2O2�ڴ��������·ֽ����ʼӿ죬�������淴Ӧ���̵ı仯����ͼ��ʾ������˵����ȷ����(����)

A. �����������С�˷�Ӧ����ЧӦ
B. ��������������H2O2��ƽ��ת����
C. H2O2�ֽ���Ȼ�ѧ����ʽ��H2O2===H2O��1/2 O2����H>0
D. ��Ӧ��������������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ȷ�������ijЩ���������ﷴӦ��ø��۵�������ʵķ�������ҵ�Ͽ�����������̼���̼���Ͻ����ۺͳ����������ȷ�Ӧ�Ļ�ѧ����ʽΪ��Fe2O3+2Al![]() 2Fe+Al2O3
2Fe+Al2O3
��1��������Ӧ�У���Ϊ��ԭ����������__����ѧʽ�������ϼ۽��͵�Ԫ����__�����ƣ���
��2������Ӧ��������0.2mol Al������Fe�����ʵ���Ϊ__mol��ת�Ƶ��ӵ����ʵ���Ϊ__mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ij�¶�ʱCH3COOH�ĵ���ƽ�ⳣ��ΪK�����¶�����20 mL 0.1 mol��L-1 CH3COOH��Һ����μ���0.1 mol��L-1 NaOH��Һ,pH�仯������ͼ��ʾ�������¶���,����������ȷ����
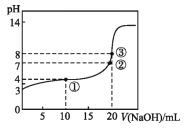
A������ͼ�����ݿɼ����KֵԼΪ1��10-5
B���٢ڢ۵�ˮ�ĵ���̶��ɴ�С��˳��Ϊ:��>��>��
C�������ʾ��Һ��:c��CH3COO-��+c��OH-��=c��CH3COOH��+c��H+��
D�����ʱc��CH3COOH��+c��CH3COO-��=0.1 mol��L-1
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com