
【题目】(1)用硫酸分解磷尾矿[主要成份为Ca5(PO4)3F]可制得中强酸磷酸H3PO4。请回答:
①Na2HPO4溶液呈碱性,则在该溶液中c(H2PO4-)_____c(PO43-)(填“>”、“<”、“=”),
向Na2HPO4溶液中加入足量的CaCl2溶液,溶液显酸性,溶液显酸性的原因是(从电离平衡移动角度分析):_____________________________。
②已知:25℃时,H3PO4的电离平衡常数:K1=7.52×10-3;K2=6.23×10-8;K3=6.23×10-13则:H3PO4(aq)+OH-(aq)![]() H2PO4-(aq)+H2O (l)的平衡常数K=______。
H2PO4-(aq)+H2O (l)的平衡常数K=______。
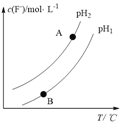
③Ca5(PO4)3F(s) +OH-(aq)![]() Ca5(PO4)3(OH) (s)+F-,该温度下,溶液中c(F-)随溶液的pH和温度(T)的变化曲线如右图所示。则:pH1___pH2(填“>”、“<”、“=”);A、B两点的溶液中F-的速率v(A)____v(B)(填“>”、 “<”、“=”)。
Ca5(PO4)3(OH) (s)+F-,该温度下,溶液中c(F-)随溶液的pH和温度(T)的变化曲线如右图所示。则:pH1___pH2(填“>”、“<”、“=”);A、B两点的溶液中F-的速率v(A)____v(B)(填“>”、 “<”、“=”)。
(2)处理含镍酸性废水可用电解法实现铁上镀镍,其装置如右图所示。

①电流方向是_____(填:a.碳棒→铁棒;b.铁棒→碳棒);
②中间隔室的可以得到的物质X是_______(填化学式);
③阳极的电极反应式为_______________;电解总反应的离子方程式为_______________。
【答案】 > Na2HPO4溶液中存在电离平衡HPO42-![]() H++PO43-,加入CaCl2溶液后的Ca2+与PO43-结合生成Ca3(PO4)2沉淀,促使Na2HPO4电离平衡向右移动,H+浓度增大溶液显酸性 7.52×1011 < > b NaCl 4OH--4e- =O2↑+2H2O 2Ni2++4OH- -
H++PO43-,加入CaCl2溶液后的Ca2+与PO43-结合生成Ca3(PO4)2沉淀,促使Na2HPO4电离平衡向右移动,H+浓度增大溶液显酸性 7.52×1011 < > b NaCl 4OH--4e- =O2↑+2H2O 2Ni2++4OH- -![]() O2↑+2Ni+2H2O
O2↑+2Ni+2H2O
【解析】(1)①Na2HPO4溶液呈碱性,所以HPO4-的水解程度大于电离程度,则c(H2PO4-)>c(PO43-);Na2HPO4溶液中存在电离平衡HPO42-![]() H++PO43-,加入CaCl2溶液,Ca2+与PO43-结合生成Ca3(PO4)2沉淀,促进Na2HPO4电离平衡向右移动,H+浓度增大,溶液显酸性。②由已知K=
H++PO43-,加入CaCl2溶液,Ca2+与PO43-结合生成Ca3(PO4)2沉淀,促进Na2HPO4电离平衡向右移动,H+浓度增大,溶液显酸性。②由已知K= =
= =
=![]() =
=![]() =7.52×1011。③由Ca5(PO4)3F(s) +OH-(aq)
=7.52×1011。③由Ca5(PO4)3F(s) +OH-(aq)![]() Ca5(PO4)3(OH) (s)+F-可得,增大OH-浓度(即增大pH),c(F-)增大,由图可得,温度相同时pH2对应的c(F-)大于pH1对应的c(F-),所以pH1<pH2;由图可得,A点温度高于B点温度,所以v(A)>v(B)。
Ca5(PO4)3(OH) (s)+F-可得,增大OH-浓度(即增大pH),c(F-)增大,由图可得,温度相同时pH2对应的c(F-)大于pH1对应的c(F-),所以pH1<pH2;由图可得,A点温度高于B点温度,所以v(A)>v(B)。
(2)①由已知:电解法实现铁上镀镍,则铁棒为阴极,电流由铁棒回到直流电源,碳棒为阳极,电流由直流电源流到碳棒,故电流方向是:b.铁棒→碳棒。②由上分析,电解过程中Na+经过阳离子交换膜进入中间隔室,Cl-经过阴离子交换膜进入中间隔室,所以中间隔室得到的物质X是NaCl。③阳极OH-放电,OH-失电子发生氧化反应,电极反应式为:4OH--4e-=O2↑+2H2O;阴极Ni2+得电子发生还原反应,故电解总反应的离子方程式为:2Ni2++4OH-![]() O2↑+2Ni+2H2O。
O2↑+2Ni+2H2O。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体还原Fe3+、I2,他们使用的药品和装置如下图所示
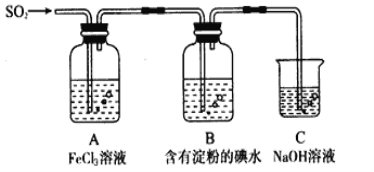
请按要求回答下列问题
(1)下列实验方案适用于在实验室制取所需SO2的是_______。
A. Na2SO3溶液与HNO3 B. Na2SO3固体与浓硫酸
C. 固体硫在纯氧中燃烧 D.铜与热浓硫酸
(2)装置C的作用是____________。如果有560mL SO2气体(已折算为标态)进入C装置中,则C中50mL NaOH溶液的物质的量浓度至少为____________mol/L才能达到目的。
(3)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:加热浓缩、冷却结晶、________、洗涤、自然干燥。在这一系列操作中没有用到的仪器有(填序号)____。
A.蒸发皿 B.分液漏斗 C.漏斗 D.玻璃棒 E.冷凝管
(4)在上述装置中通入过量的SO2,请设计实验验证SO2与Fe3+发生了氧化还原反应________________。
(5)本实验中能表明SO2的还原性比I-的还原性强的现象是__________________,其反应的离子方程式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明代宋应星著的《天工开物》中有关于“火法”冶炼锌的工艺记载:“炉甘石(主要成分为碳酸锌)十斤,装载入一泥罐内,……然后逐层用煤炭饼垫盛,其底铺薪,发火煅红,……,冷淀,毁罐取出,……,即倭铅也。”则下列说法不正确的是
A. 该冶炼锌的反应中包含有氧化还原反应
B. 上述高温煅烧时实质是CO还原ZnO
C. 古人把锌称倭铅是因为锌和铅的化学性质相同
D. 冶炼 Zn 的总反应方程式为: 2ZnCO3+C![]() 2Zn+3CO2↑
2Zn+3CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25 ℃时,将1.0L c molL-1CH3COOH溶液与0.1molNaOH固体混合,使之充分反应。然后向该混合溶液中加入少量CH3COOH或CH3COONa固体(忽略体积和温度变化),引起溶液pH的变化如图所示。下列叙述错误的是
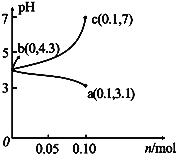
A. 水的电离程度:c>b>a
B. a点对应的混合溶液中,c(CH3COOH)>c(Na+ )>c(OH-)
C. 当混合溶液呈中性时,c(Na+ )=c(CH3COO-)>c(H+) =c(OH-)
D. 该温度下,醋酸的电离平衡常数![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能作为判断元素的非金属性强弱依据的是( )
A. 元素的最高价氧化物对应水化物的酸性强弱
B. 元素的单质跟氢气反应生成气态氢化物的难易程度
C. 非金属元素对应的气态氢化物的稳定性
D. 非金属元素单质的熔点和沸点的高低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据如图所示的N2(g)和O2(g)反应生成NO(g)过程中能量变化情况,判断下列说法错误的是 ( )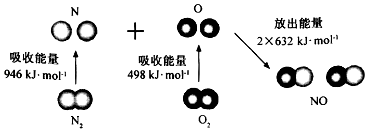
A.直观看,该反应中反应物所具有的总能量低于生成物所具有的总能量
B.2 mol气态氧原子结合生成O2(g)时,能放出498 KJ能量
C.断裂1 mol NO分子中的化学键,需要吸收632KJ能量
D.该反应的热化学方程式为:N2+O2═2NO△H=+180KJ/mol.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.毛发和蚕丝的主要成分都是蛋白质
B.天然气和沼气的主要成分都是甲烷
C.油脂氢化、氨基酸形成多肽、蛋白质水解都属于取代反应
D.氨基乙酸、乙醛、乙二醇均可发生聚合反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如下图,(该有机物溶于水)为了证实该有机物的结构和性质,你认为应先检验________(填官能团名称),所选检验试剂是_________(填试剂名称);其次检验________(填官能团名称),所以选检验试剂是________(填试剂名称);最后检验________(填官能团名称),所选检验试剂是________(填试剂名称)。
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com