
【题目】不能作为判断元素的非金属性强弱依据的是( )
A. 元素的最高价氧化物对应水化物的酸性强弱
B. 元素的单质跟氢气反应生成气态氢化物的难易程度
C. 非金属元素对应的气态氢化物的稳定性
D. 非金属元素单质的熔点和沸点的高低
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】AlN广泛应用于电子、陶瓷等工业领域。在一定条件下,AlN可通过反应Al2O3+N2+3C![]() 2AlN+3CO合成。下列叙述正确的是( )
2AlN+3CO合成。下列叙述正确的是( )
A. AlN为氧化产物
B. AlN的摩尔质量为41g
C. 上述反应中,每生成1molAlN需转移3mol电子
D. 上述反应中,N2是还原剂,Al2O3是氧化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质中,按单质、化合物、混合物顺序排列的是
A. 铜、空气、水 B. 生石灰、熟石灰、烧碱
C. 氧气、干冰、浓硫酸 D. 纯碱、水银、胆矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钢铁是目前应用最广泛的金属材料,了解钢铁腐蚀的原因与防护方法具有重要意义,对钢铁制品进行抗腐蚀处理,可适当延长其使用寿命。
(1)抗腐蚀处理前,生产中常用盐酸来除铁锈。现将一表面生锈的铁件放入盐酸中,当铁锈除尽后,溶液中发生的化合反应的化学方程式为:________________________。

(2)利用上图装置,可以模拟铁的电化学防护。
①若X为碳棒,为减缓铁件的腐蚀,开关K应置于________处。
②若X为锌,开关K置于M处,该电化学防护法称为________。
(3)上图中若X为粗铜,容器中海水替换为硫酸铜溶液,开关K置于N处,一段时间后,当铁件质量增加3.2 g时,X电极溶解的铜的质量________3.2 g(填“<”“>”或“=”)。
(4)上图中若X为铜,容器中海水替换为FeCl3溶液,开关K置于M处,铜电极发生的反应是 ,若将开关K置于N处,发生的总反应是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)用硫酸分解磷尾矿[主要成份为Ca5(PO4)3F]可制得中强酸磷酸H3PO4。请回答:
①Na2HPO4溶液呈碱性,则在该溶液中c(H2PO4-)_____c(PO43-)(填“>”、“<”、“=”),
向Na2HPO4溶液中加入足量的CaCl2溶液,溶液显酸性,溶液显酸性的原因是(从电离平衡移动角度分析):_____________________________。
②已知:25℃时,H3PO4的电离平衡常数:K1=7.52×10-3;K2=6.23×10-8;K3=6.23×10-13则:H3PO4(aq)+OH-(aq)![]() H2PO4-(aq)+H2O (l)的平衡常数K=______。
H2PO4-(aq)+H2O (l)的平衡常数K=______。
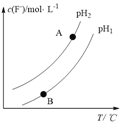
③Ca5(PO4)3F(s) +OH-(aq)![]() Ca5(PO4)3(OH) (s)+F-,该温度下,溶液中c(F-)随溶液的pH和温度(T)的变化曲线如右图所示。则:pH1___pH2(填“>”、“<”、“=”);A、B两点的溶液中F-的速率v(A)____v(B)(填“>”、 “<”、“=”)。
Ca5(PO4)3(OH) (s)+F-,该温度下,溶液中c(F-)随溶液的pH和温度(T)的变化曲线如右图所示。则:pH1___pH2(填“>”、“<”、“=”);A、B两点的溶液中F-的速率v(A)____v(B)(填“>”、 “<”、“=”)。
(2)处理含镍酸性废水可用电解法实现铁上镀镍,其装置如右图所示。

①电流方向是_____(填:a.碳棒→铁棒;b.铁棒→碳棒);
②中间隔室的可以得到的物质X是_______(填化学式);
③阳极的电极反应式为_______________;电解总反应的离子方程式为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】充分利用黄铁矿(主要成份为FeS2)对资源和环境具有重要的意义。
(1)一种酸性条件下催化氧化黄铁矿的物质转化关系如下面图Ⅰ所示。
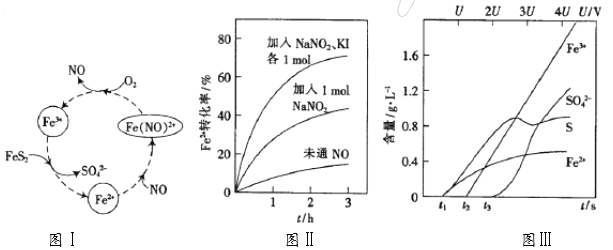
①图Ⅰ中,NO起的是_____作用;O2氧化FeS2生成Fe3+的离子方程式为____________;
②硝酸也可以将FeS2氧化为Fe3+和SO42-,但使用稀硝酸比浓硝酸的反应速率快很多,其原因是:_________。
(2)控制Fe3+的浓度、溶液体积和通入O2的速率一定,图Ⅱ表示当改变其它条件时Fe2+被氧化的转化率随时间的变化。
①加入NaNO2发生反应:3NO2-+2H+==NO3-+2NO↑+H2O。若3molNaNO2完全反应,则转移的电子数为____________________mol。
②在酸性溶液中,加入NaNO2、KI发生反应生成NO和I2,该离子反应方程式为______ ;图Ⅱ中曲线从下至上, Fe2+转化速率依次增大的原因是________。
(3)为研究FeS2作电极时的放电规律,以FeS2作阳极进行电解,由FeS2放电产生的粒子的含量与时间(t)、电压(U)之间的关系如图Ⅲ所示。
①t1至t2间FeS2发生的电极反应式为_________________。
②当电压值介于3.5U~4.4U之间时,FeS2放电所得的主要粒子为_______________。
③黄铁矿含有杂质钴和镍。若电解一段时间,c(Fe3+)=1×10-2mol·L-1时,通过计算判断:pH控制为_______不会产生Fe(OH)3沉淀;当使Co2+沉淀完全时,Fe3+_____(填:“已经”或“没有”)开始沉淀。{已知:离子浓度≤1×10–5mol·L–1认为沉淀完全;Ksp[Fe(OH)3]=3.8×10–38、Ksp[Co(OH)2]=2×10–15, ![]() = – 0.16}
= – 0.16}
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学常见无机物A、B、C、D、E、X均由短周期元素组成,且存在如下图转化关系(部分反应物、生成物和反应条件略去)。下列推断不正确的是

A. 若D为白色沉淀,且与A的摩尔质置相等,则X—定是铝盐
B. 若A是单质,B和D的反应是OH-+HCO3-=H2O+HCO32-,则E—定能还原CuO
C. 若B、X均为单质,D为CO,C能和E反应,则E为NaOH
D. 若X是Na2SO3,C是能使品红溶液褪色的气体,则A可能是氯气,且D和E不反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com