
【题目】充分利用黄铁矿(主要成份为FeS2)对资源和环境具有重要的意义。
(1)一种酸性条件下催化氧化黄铁矿的物质转化关系如下面图Ⅰ所示。
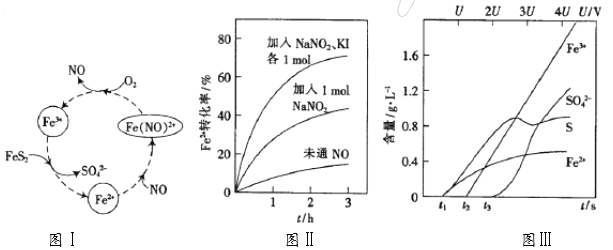
①图Ⅰ中,NO起的是_____作用;O2氧化FeS2生成Fe3+的离子方程式为____________;
②硝酸也可以将FeS2氧化为Fe3+和SO42-,但使用稀硝酸比浓硝酸的反应速率快很多,其原因是:_________。
(2)控制Fe3+的浓度、溶液体积和通入O2的速率一定,图Ⅱ表示当改变其它条件时Fe2+被氧化的转化率随时间的变化。
①加入NaNO2发生反应:3NO2-+2H+==NO3-+2NO↑+H2O。若3molNaNO2完全反应,则转移的电子数为____________________mol。
②在酸性溶液中,加入NaNO2、KI发生反应生成NO和I2,该离子反应方程式为______ ;图Ⅱ中曲线从下至上, Fe2+转化速率依次增大的原因是________。
(3)为研究FeS2作电极时的放电规律,以FeS2作阳极进行电解,由FeS2放电产生的粒子的含量与时间(t)、电压(U)之间的关系如图Ⅲ所示。
①t1至t2间FeS2发生的电极反应式为_________________。
②当电压值介于3.5U~4.4U之间时,FeS2放电所得的主要粒子为_______________。
③黄铁矿含有杂质钴和镍。若电解一段时间,c(Fe3+)=1×10-2mol·L-1时,通过计算判断:pH控制为_______不会产生Fe(OH)3沉淀;当使Co2+沉淀完全时,Fe3+_____(填:“已经”或“没有”)开始沉淀。{已知:离子浓度≤1×10–5mol·L–1认为沉淀完全;Ksp[Fe(OH)3]=3.8×10–38、Ksp[Co(OH)2]=2×10–15, ![]() = – 0.16}
= – 0.16}
【答案】 催化 15O2+4FeS2+2H2O =4Fe3++8SO42-+4H+ 反应后稀硝酸被还原为NO起催化剂作用,浓硝酸被还原为NO2不能起催化剂作用 2 2NO2-+2I-+4H+=I2+2NO↑+2H2O 同量的NaNO2产生催化剂NO的量更多,加快了化学反应速率 FeS2-2e-=Fe2++2S Fe3+、SO42- ≤2.16 【答题空10】已经
【解析】(1)①分析图Ⅰ,Fe2+与NO结合成Fe(NO)2+,Fe(NO)2+与O2反应生成NO和Fe3+,由此可得,NO参与反应,在反应前后没有发生变化,所以NO作催化剂起催化作用;由图Ⅰ可看出O2氧化FeS2生成Fe3+,同时-1价S元素被氧化成+6价生成SO42-,0价O元素被还原成-2价,根据得失电子守恒(化合价升降总数相等)和元素守恒可得离子方程式为:15O2+4FeS2+2H2O =4Fe3++8SO42-+4H+。②硝酸将FeS2氧化为Fe3+和SO42-,但浓硝酸和稀硝酸被还原的产物不同,稀硝酸反应后被还原为NO,浓硝酸被还原为NO2,NO可作催化剂,而NO2不能,所以使用稀硝酸比浓硝酸的反应速率快很多。
(2)①根据反应方程式,NO2-中+3价N元素一部分升为+5价,一部分降为+2价,发生自身氧化还原反应,每3mol NO2-反应,有1mol NO2-作氧化剂2molNO2-作还原剂,则3molNaNO2完全反应转移2mol电子。②在酸性溶液中,加入NaNO2、KI发生反应生成NO和I2,N元素化合价由+3降为+2,I元素化合价由-1升为0,根据得失电子守恒(化合价升降总数相等)和元素守恒可得离子方程式为:2NO2-+2I-+4H+=I2+2NO↑+2H2O;NO可作该反应的催化剂,未通入NO则反应速率很慢,相同量的NaNO2,与KI反应产生催化剂NO的量更多,所以加快了化学反应速率。
(3)分析图Ⅲ:①t1至t2间Fe2+和S的含量增加,所以FeS2发生的电极反应式为:FeS2-2e-=Fe2++2S。②当电压值介于3.5U~4.4U之间时,Fe3+和SO42-含量增加,所以FeS2放电所得的主要粒子为:Fe3+、SO42-。③当Q[Fe(OH)3]≤Ksp[Fe(OH)3]时,不会产生Fe(OH)3沉淀,由Q[Fe(OH)3]=Ksp[Fe(OH)3]得,c(Fe3+)c3(OH-)=Ksp[Fe(OH)3],代入数据得:1×10-2×c3(OH-)=3.8×10–38,解得:c(OH-)=![]() mol·L-1,根据c(H+)c(OH-)=KW,常温下KW=1×10-14,代入数据解得:c(H+)=
mol·L-1,根据c(H+)c(OH-)=KW,常温下KW=1×10-14,代入数据解得:c(H+)=![]() ,pH=-
,pH=- ![]() = -
= - ![]() =2.16,所以pH=2.16时刚好Q[Fe(OH)3]=Ksp[Fe(OH)3],pH≤2.16时不会产生Fe(OH)3沉淀;根据Q[Co(OH)2]=Ksp[Co(OH)2]得,c(Co2+)c2(OH-)=Ksp[Co(OH)2],所以c(OH-)=
=2.16,所以pH=2.16时刚好Q[Fe(OH)3]=Ksp[Fe(OH)3],pH≤2.16时不会产生Fe(OH)3沉淀;根据Q[Co(OH)2]=Ksp[Co(OH)2]得,c(Co2+)c2(OH-)=Ksp[Co(OH)2],所以c(OH-)=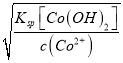 ,当Co2+沉淀完全时,代入相关数据得:c(OH-)=
,当Co2+沉淀完全时,代入相关数据得:c(OH-)= ≥
≥![]() ×10-5 mol·L-1,所以此时Fe3+已经开始沉淀。
×10-5 mol·L-1,所以此时Fe3+已经开始沉淀。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】依据氧化还原反应:2Ag+(aq) + Cu(s)Cu2+(aq) + 2Ag(s)设计的原电池如图所示。
请回答下列问题:
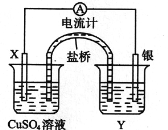
(1)电极X的材料是____________________;电解质溶液Y是____________;
(2)银电极为电池的___________极,发生的电极反应为_____________________;X电极上发生的电极反应为_____________________。
(3)外电路中的电子是从___________电极流向___________电极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】TiO2在光照射下可使水分解:2H2O![]() 2H2↑+O2↑,该过程类似植物的光合作用。图中是光照射下TiO2分解水的装置示意图。下列叙述正确的是
2H2↑+O2↑,该过程类似植物的光合作用。图中是光照射下TiO2分解水的装置示意图。下列叙述正确的是
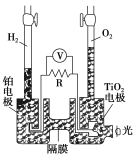
A.该装置可以将光能转化为电能,同时也能将其转化为化学能
B.TiO2电极上发生的反应为:2H++2e-===H2↑
C.该装置工作时,电流由TiO2电极经R流向铂电极
D.该装置工作时,TiO2电极附近溶液的pH变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不能作为判断元素的非金属性强弱依据的是( )
A. 元素的最高价氧化物对应水化物的酸性强弱
B. 元素的单质跟氢气反应生成气态氢化物的难易程度
C. 非金属元素对应的气态氢化物的稳定性
D. 非金属元素单质的熔点和沸点的高低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏伽德罗常数的值,下列叙述中正确的是
A. 常温常压下,6g O2和26g O3混合气体中的原子总数为2NA
B. 100mL 0.1mol/L 的NaOH溶液中,所含微粒总数为0.02NA
C. 23g 金属钠变为钠离子时得到的电子数为NA
D. 标准状况下,2.24L H2O所含的原子数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据有关报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程.反应过程如图:下列说法中正确的是( ) 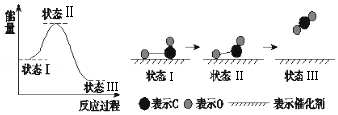
A.状态Ⅰ→状态Ⅲ是放热过程
B.该过程中,CO先断键形成C和O,再生成CO2
C.状态Ⅰ→状态Ⅲ表示CO和O2反应,生成了CO2
D.状态Ⅰ→状态Ⅱ表示催化剂对反应没有起作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关Na2CO3和NaHCO3的性质比较中,正确的是
A. 热稳定性:Na2CO3 < NaHCO3
B. 常温时水溶性:Na2CO3 > NaHCO3
C. 与稀盐酸反应速率:Na2CO3 < NaHCO3
D. 相对分子质量:Na2CO3 < NaHCO3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com