
【题目】煤的综合利用对于改善大气质量和能源充分利用有重要的意义。
(1)下列说法正确的是 (填序号)。
a.煤是由有机物和少量无机物组成的复杂混合物
b.煤在燃烧过程中会生成一氧化碳、二氧化碳、氮氧化物、烟尘等有害物质
c.可利用生石灰、熟石灰、石灰石等固硫剂使煤在燃烧过程中生成稳定的硫酸盐
d.煤的干馏属于化学变化,煤的气化和液化都属于物理变化
(2)煤的气化过程中产生的有害气体H2S用氨水吸收生成正盐的离子方程式是
。
(3)燃煤烟气的一种脱硫方案-火碱-石灰-石膏法流程图1如下:
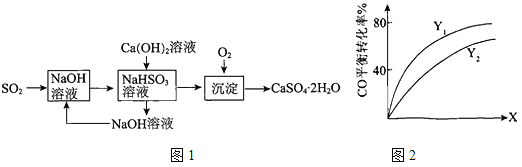
①常温下,用NaOH溶液吸收SO2得到pH=6的NaHSO3溶液,该溶液中离子浓度的大小顺序是
。
②氢氧化钙与NaHSO3反应的化学方程式是 。
(4)煤的间接液化法合成二甲醚的三步反应如下:
Ⅰ.2H2(g)+CO(g) ![]() CH3OH(g) △H=-90.8kJ·mol-1
CH3OH(g) △H=-90.8kJ·mol-1
Ⅱ.2CH3OH(g) ![]() CH3OCH3(g)+ H2O(g) △H=-23.5 kJ·mol-1
CH3OCH3(g)+ H2O(g) △H=-23.5 kJ·mol-1
Ⅲ.CO(g) + H2O(g) ![]() CO2(g) + H2(g) △H=-41.3 kJ·mol-1
CO2(g) + H2(g) △H=-41.3 kJ·mol-1
① 总反应热化学方程式:3H2(g)+ 3CO(g) ![]() CH3OCH3(g)+ CO2(g) △H=
CH3OCH3(g)+ CO2(g) △H=
② Y(Y1、Y2),X可分别代表压强或温度。如图2表示Y一定时,总反应中CO的平衡转化率随X的变化关系。判断Y1、Y2的大小关系,并简述理由:
。
【答案】
(1)abc
(2)H2S+2NH3·H2O==2NH4++S2-+2H2O
(3)①c(Na+)﹥c(HSO3-)﹥c(H+)﹥c(SO32-)﹥c(OH-) ②Ca(OH)2+ NaHSO3== CaSO3↓+NaOH+ H2O
(4)①-246.4 kJ·mol-1 ②Y1﹤Y2 由3H2(g)+ 3CO(g) ![]() CH3OCH3(g)+ CO2(g)可知,压强增大,CO的平衡转化率增大,温度升高,CO的平衡转化率减小,所以X代表温度,压强一定时,温度越低平衡转化率越大。
CH3OCH3(g)+ CO2(g)可知,压强增大,CO的平衡转化率增大,温度升高,CO的平衡转化率减小,所以X代表温度,压强一定时,温度越低平衡转化率越大。
【解析】
试题分析:
(1)a.煤是由有机物和少量无机物组成的复杂的混合物,主要含有C元素,故a正确;b.煤中伴有硫元素和氮元素,不完全燃烧时生成一氧化碳、二氧化硫、氮氧化物、烟尘等有毒物质,故b正确;c.碳酸钙受热分解为氧化钙,二氧化硫是酸性氧化物,能与氢氧化钙、氧化钙发生反应生成亚硫酸钙,然后被氧气氧化生成稳定的硫酸盐,故c正确;d.煤的干馏、煤的气化和液化都属于化学变化,故d错误;故答案为:abc。
(2)H2S用氨水吸收生成正盐硫化铵和水,离子方程式为H2S+2NH3·H2O==2NH4++S2-+2H2O,故答案为:H2S+2NH3·H2O==2NH4++S2-+2H2O;
(3)①常温下,NaHSO3溶液的pH=6,NaHSO3溶液呈酸性,据此分析:电离程度大于水解程度;故离子浓度的大小为c(Na+)﹥c(HSO3-)﹥c(H+)﹥c(SO32-)﹥c(OH-),故答案为:c(Na+)﹥c(HSO3-)﹥c(H+)﹥c(SO32-)﹥c(OH-);②氢氧化钙与NaHSO3反应生成沉淀亚硫酸钙、NaOH和水,化学方程式为Ca(OH)2+ NaHSO3== CaSO3↓+NaOH+ H2O,故答案为:Ca(OH)2+ NaHSO3== CaSO3↓+NaOH+ H2O;
(4)①题中,由盖斯定律Ⅱ+Ⅲ+Ⅰ×2得到3H2(g)+3CO(g) ![]() CH3OCH3(g)+ CO2(g) 的△H=-246.4 kJ·mol-1,故答案为:-246.4 kJ·mol-1;②3H2(g)+3CO(g)
CH3OCH3(g)+ CO2(g) 的△H=-246.4 kJ·mol-1,故答案为:-246.4 kJ·mol-1;②3H2(g)+3CO(g) ![]() CH3OCH3(g)+ CO2(g) △H﹤0,正反应气体体积减小,升高温度,平衡逆向移动,CO的平衡转化率减小,增大压强,平衡正向移动,CO的平衡转化率增大,因此X代表压强,Y代表温度;等压强条件下,温度越高,CO的平衡转化率越小,因此Y1﹤Y2,故答案为:Y1﹤Y2,由3H2(g)+ 3CO(g)
CH3OCH3(g)+ CO2(g) △H﹤0,正反应气体体积减小,升高温度,平衡逆向移动,CO的平衡转化率减小,增大压强,平衡正向移动,CO的平衡转化率增大,因此X代表压强,Y代表温度;等压强条件下,温度越高,CO的平衡转化率越小,因此Y1﹤Y2,故答案为:Y1﹤Y2,由3H2(g)+ 3CO(g) ![]() CH3OCH3(g)+ CO2(g)可知,压强增大,CO的平衡转化率增大,温度升高,CO的平衡转化率减小,所以X代表温度,压强一定时,温度越低平衡转化率越大。
CH3OCH3(g)+ CO2(g)可知,压强增大,CO的平衡转化率增大,温度升高,CO的平衡转化率减小,所以X代表温度,压强一定时,温度越低平衡转化率越大。


科目:高中化学 来源: 题型:
【题目】一定温度下,在容积为2 L的密闭容器中投入一定量M、N进行反应,M、N的物质的量随时间的变化曲线如图所示:
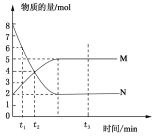
(1)写出此反应的化学方程式________________________。
(2)下列叙述中能说明上述反应达到平衡状态的是_____。
A.反应中M与N的物质的量之比为1:1
B.在混合气体中N的质量百分数保持不变
C.混合气体的平均摩尔质量不随时间的变化而变化
D.混合气体的压强不随时间的变化而变化
(3)若t3=3,则3min内用M表示的反应速率是 。
(4)在t2时刻正反应速率v(正)与逆反应速率v(逆)的大小关系是 。
(5)反应达到平衡后,N所占的体积分数是 (保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)是一种集氧化、吸附、絮凝于一体的新型多功能水处理剂。其生产工艺如下:
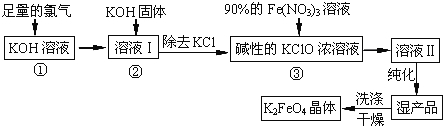
(1)反应①应在温度较低的情况下进行.因在温度较高时KOH 与Cl2 反应生成的是KClO3.写出在温度较高时KOH 与Cl2反应的化学方程式 ;
(2)在反应液I中加入KOH固体的目的是 (填编号);
A.与反应液I中过量的Cl2继续反应,生成更多的KClO
B.KOH固体溶解时会放出较多的热量,有利于提高反应速率
C.为下一步反应提供碱性的环境
D.使KClO3转化为 KClO
(3)从溶液II中分离出K2FeO4后,还会有副产品KNO3、KCl,则反应③中发生的离子反应方程式为 。
(4)如何判断K2FeO4晶体已经洗涤干净 。
(5)高铁酸钾(K2FeO4)作为水处理剂的一个优点是能与水反应生成胶体吸附杂质,其离子反应是: FeO42﹣+ H2O= Fe(OH)3(胶体)+ O2↑+
完成并配平上述反应的离子方程式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由环己烷可制得1,4-环己二醇,流程如下(其中无机产物都已略去),试回答:

(1)反应_________属于取代反应(填反应序号).
(2)化合物的结构简式:B______________,C_______________.
(3)反应⑥所用试剂和条件是________________________.
(4)写出反应②、⑤的化学方程式:反应②________________反应⑤__________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R是短周期元素,原子序数依次增大。X原子核外各层电子数之比为1:2,Y原子和Z原子的核外电子数之和为20,W和R是同周期相邻元素,Y的氧化物和R的氧化物均能形成酸雨。
请回答下列问题:
(1)元素X的最高价氧化物的电子式为 ;元素Z的离子结构示意图为 。
(2)单质X和元素Y的最高价氧化物对应水化物的浓溶液发生反应的化学方程式为 。Y、W的氢化物沸点高的是 (写化学式),原因是 。
(3)元素W位于周期表的第 族, 其非金属性比元素R弱,用原子结构的知识解释原因 。
(4) Y和Z组成的化合物ZY,被大量用于制造电子元件。工业上用Z的氧化物、X单质和Y单质在高温下制备ZY,其中Z的氧化物和X单质的物质的量之比为1:3,则该反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨基甲酸铵(NH2COONH4,简称甲铵)是CO2和NH3制尿素的中间产物,其中CO2反应生成甲铵的能量变化如下图所示。
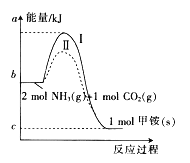
(1)图中反应为可逆反应,则生成甲铵的反应是 (填“放热”或“吸热”)反应。
(2)合成甲铵的热化学方程式为 。
(3)对于同一反应,图中虚线(Ⅱ)与实线(Ⅰ)相比,活化能大大降低,其原因是 。
(4)已知由甲铵合成尿素的反应为NH2COONH4(s)![]()
![]() ;
;![]() ,则由CO2(g)和NH3(g)直接合成固态尿素并生成液态水的热化学方程式为 。
,则由CO2(g)和NH3(g)直接合成固态尿素并生成液态水的热化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某人设计淀粉利用方案如图所示。其中:A能催熟水果,B是高分子化合物,D是有水果香味的物质。请回答以下问题:
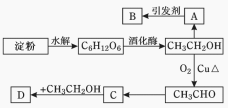
(1)C6H12O6的名称是________,A的电子式为_________,C中含有官能团名称 ;
(2)A→B反应类型____________;C→D反应类型____________。
(3)写出下列转化的化学方程式:
① A→B:______________________________________________________;
② A→CH3CH2OH:______________________________________;
③ C→D:_____________________________________________________;
④ CH3CH2OH→CH3CHO:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究碳、氮的单质及其化合物的反应对缓解环境污染、能源危机具有重要意义。
(1)已知反应CO(g)+2H2(g)![]() CH3OH(g) ΔH=-99kJ·mol-1中的相关化学键能如下:
CH3OH(g) ΔH=-99kJ·mol-1中的相关化学键能如下:
![]()
则x= 。
(2)甲醇作为一种重要的化工原料,既可以作为燃料,还可用于合成其它化工原料。在一定条件下可利用甲醇羰基化法制取甲酸甲酯,其反应原理可表示为:CH3OH(g) +CO(g) ![]() HCOOCH3(g) ΔH=-29.1kJ·mol-1。向体积为2L的密闭容器中充入2mol CH3OH(g) 和2mol CO,测得容器内的压强(p:kPa)随时间(min)的变化关系如下图中Ⅰ、Ⅱ、Ⅲ曲线所示:
HCOOCH3(g) ΔH=-29.1kJ·mol-1。向体积为2L的密闭容器中充入2mol CH3OH(g) 和2mol CO,测得容器内的压强(p:kPa)随时间(min)的变化关系如下图中Ⅰ、Ⅱ、Ⅲ曲线所示:

①Ⅱ和Ⅰ相比,改变的反应条件是 。
②反应Ⅰ在5min时达到平衡,在此条件下从反应开始到达到平衡时v(HCOOCH3)= 。
③反应Ⅱ在2min时达到平衡,平衡常数K(Ⅱ) = 。在体积和温度不变的条件下,在上述反应达到平衡Ⅱ时,再往容器中加入1mol CO和2mol HCOOCH3后v(正) v(逆)(填“﹥”“﹤”“﹦”),原因是 。
④比较反应Ⅰ的温度(T1)和反应Ⅲ的温度(T3)的高低:T1 T3(填“﹥”“﹤”“﹦”),判断的理由是 。
(3)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2。某研究小组在实验室用某新型催化剂对CO、NO催化转化进行研究,测得NO转化为N2的转化率随温度、CO混存量的变化情况如下图所示,利用以下反应填空:
NO+CO![]() N2+ CO2(有CO) 2NO
N2+ CO2(有CO) 2NO![]() N2+ O2(无CO)
N2+ O2(无CO)
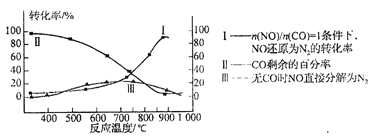
①若不使用CO,温度超过775℃,发现NO的分解率降低,其可能的原因为 。
②在n(NO)/ n(CO)=1的条件下,应控制最佳温度在 左右。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
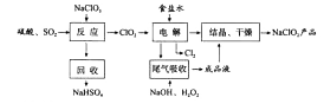
回答下列问题:
(1)NaClO2中Cl的化合价为_______。
(2)写出“反应”步骤中生成ClO2的化学方程式_______。
(3)“电解”所用食盐水由粗盐水精制而成,精制时,为除去Mg2+和Ca2+,要加入的试剂分别为________、________。“电解”中阴极反应的主要产物是______。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO2。此吸收反应中,氧化剂与还原剂的物质的量之比为________,该反应中氧化产物是_________。
(5)“有效氯含量”可用来衡量含氯消毒剂的消毒能力,其定义是:每克含氯消毒剂的氧化能力相当于多少克Cl2的氧化能力。NaClO2的有效氯含量为____。(计算结果保留两位小数)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com