
【题目】下列说法中正确的是
A. C4H4只有![]() 和CH
和CH![]() C—CH=CH2两种同分异构体
C—CH=CH2两种同分异构体
B. 丙烯分子所有原子均在同一平面上
C. 向溴水中分别通入乙烯和加入苯,都能观察到溴水褪色现象,但原因不同
D. 芳香烃![]() 和
和![]() 的一氯代物都只有2种
的一氯代物都只有2种
科目:高中化学 来源: 题型:
【题目】某烃为无色晶体,结构分析证实:①分子中含有8个碳原子,②每个碳原子都以三条单键分别与三个碳原子相连,③碳碳键之间只有一种键角。则该分子式为:____________。它的结构简式为(写键线式)_____________。它的含苯环的同分异构体的结构简式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25℃时,0.1000mol·L-lCH3COOH溶液中CH3COOH的电离度(×100%)约为1%。该温度下,用0.1000mol·L-l氨水滴定10.00mL0.1000mol·L-lCH3COOH溶液,溶液的pH与溶液的导电能力(I)的关系如图所示。下列说法中正确的是( )
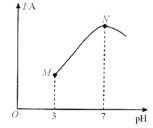
A.M点→N点,水的电离程度逐渐增大
B.25℃时,CH3COOH 的电离常数约为1.0×10-2
C.N点溶液中,c(CH3COO-)>c(NH4+)
D.当滴入20 mL氨水时,溶液中c(CH3COO-)>c(NH4+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁碳微电解技术是利用原电池原理处理酸性污水的一种工艺,装置如图所示。若上端开口关闭,可得到强还原性的H·(氢原子);若上端开口打开,并鼓入空气,可得到强氧化性的·OH(羟基自由基)。下列说法错误的是
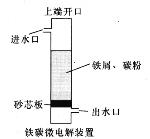
A. 无论是否鼓入空气,负极的电极反应式均为Fe-2e—===Fe2+
B. 不鼓入空气时,正极的电极反应式为H++e—===H·
C. 鼓入空气时,每生成1mol·OH有2 mol电子发生转移
D. 处理含有草酸(H2C2O4)的污水时,上端开口应打开并鼓入空气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的恒容密闭容器中,不能说明反应NH2COONH4(s)![]() 2NH3(g)+CO2(g)达到平衡状态的是
2NH3(g)+CO2(g)达到平衡状态的是
A. 混合气体的密度不再发生变化
B. 混合气体的总物质的量不再发生变化
C. 混合气体的平均相对分子质量不再发生变化
D. 混合气体的压强不再发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图是部分短周期元素化合价与原子序数的关系图,下列说法正确的是
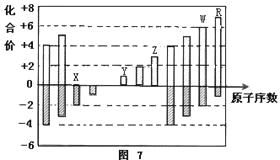 [
[
A. X的氢化物形成的晶体中存在的最强作用力是分子间作用力
B. R的气态氢化物溶于水,离子键断裂
C. W的气态氢化物是离子化合物
D. Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验事实得出的结论正确的是( )
A.由SiO2不能与水反应生成H2SiO3,可知SiO2不是酸性氧化物
B.由SiO2+2C![]() Si+2CO↑,可知碳的非金属性大于硅
Si+2CO↑,可知碳的非金属性大于硅
C.CO2通入Na2SiO3溶液产生白色沉淀,可知酸性H2CO3>H2SiO3
D.SiO2与NaOH溶液反应,也可与氢氟酸反应,则SiO2为两性氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)分别写出下列物质的电子式:
N2______________ NaOH______ H2O2_________
(2)写出下列反应的化学方程式:
硅单质与氢氧化钠溶液的反应:_________。
二氧化氮与水反应:___________。
铜和浓硫酸加热反应:___________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于在一个密闭容器中进行的反应C(s)+H2O(g) ![]() CO(g)+H2(g) ,下列条件的改变对反应速率几乎没有影响的是
CO(g)+H2(g) ,下列条件的改变对反应速率几乎没有影响的是
①增加C的量; ②增加CO的量;
③将容器的体积缩小一半; ④保持体积不变,充入N2以增大压强;
⑤升高反应体系的温度; ⑥保持压强不变,充入N2以增大体积。
A. ②③ B. ①④ C. ①⑥ D. ④⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com