
【题目】按要求回答下列问题:
(1) 命名为“2-乙基丙烷”,错误原因是___________;将其命名为“3-甲基丁烷”,错误原因是___________。正确命名为___________。
命名为“2-乙基丙烷”,错误原因是___________;将其命名为“3-甲基丁烷”,错误原因是___________。正确命名为___________。
(2) 的名称为___________________。
的名称为___________________。
【答案】没有选择碳原子数最多的作为主链 没有把取代基位置定在最小 2-甲基丁烷 2,5,5-三甲基-4-乙基庚烷
【解析】
根据系统命名法的命名规则分析解答。
(1)根据命名规则,可以知道 命名为“2-乙基丙烷”,错误原因是没有选择碳原子数最多的作为主链;命名为“3-甲基丁烷”,错误原因是没有把取代基位置定在最小,正确命名为:2-甲基丁烷;故答案为:没有选择碳原子数最多的作为主链;没有把取代基位置定在最小;2-甲基丁烷;
命名为“2-乙基丙烷”,错误原因是没有选择碳原子数最多的作为主链;命名为“3-甲基丁烷”,错误原因是没有把取代基位置定在最小,正确命名为:2-甲基丁烷;故答案为:没有选择碳原子数最多的作为主链;没有把取代基位置定在最小;2-甲基丁烷;
(2)根据系统命名规则,最长的碳链有7个碳原子,主链为庚烷,从右端离取代基近的一端开始给碳原子编号,2号碳和5号碳上一共有3个甲基,4号碳上有1个乙基,所以命名为:2,5,5-三甲基-4-乙基庚烷,故答案为:2,5,5-三甲基-4-乙基庚烷。


 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】下列实验现象与实验操作不相匹配的是
实验操作 | 实验现象 | |
A | 向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 | 溶液的紫色逐渐褪去,静置后溶液分层 |
B | 将镁条点燃后迅速伸入集满CO2的集气瓶 | 集气瓶中产生浓烟并有黑色颗粒产生 |
C | 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 | 有刺激性气味气体产生,溶液变浑浊 |
D | 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 | 黄色逐渐消失,加KSCN后溶液颜色不变 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl2是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水FeCl2。有关物质的性质如下:
C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H4Cl2、苯,易溶于乙醇,易吸水 | ||
熔点/℃ | -45 | 53 | 易升华 | |
沸点/℃ | 132 | 173 | ---------------------- | -------------------- |
(1)H2还原无水FeCl3制取FeCl2。有关装置如图:
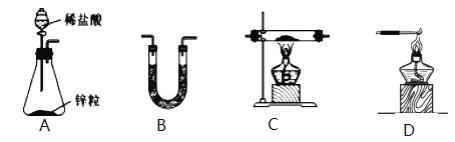
①H2还原无水FeCl3制取FeCl2的化学方程式为_____。
②按气流由左到右的方向,上述仪器的连接顺序为_____。(填字母,装置可多次使用);B中盛放的试剂是_____。
③该制备装置的缺点为_____。
(2)利用反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl↑,制取无水FeCl2并测定FeCl3的转化率。按如图装置,在三颈烧瓶中放入32.5g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。

①仪器a的作用是_____。
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是_____,回收滤液中C6H5C1的操作是_____。
③反应后将锥形瓶中溶液配成250mL,量取25.00mL所配溶液,用0.40mol/L NaOH溶液滴定,终点时消耗NaOH溶液为19.60mL,则氯化铁的转化率为_____。
④为了减少实验误差,在制取无水FeCl2过程中应采取的措施有:_____(写出一点即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2和H2在催化剂表面合成氨的微观历程及能量变化的示意图如图所示,用![]() 、、
、、![]() 分别表示N2、H2、NH3,下列说法正确的是( )
分别表示N2、H2、NH3,下列说法正确的是( )
![]()
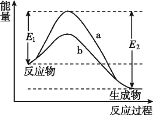
A.使用催化剂时,合成氨的反应放出的热量减少
B.在该过程中,N2、H2 断键形成 N 原子和 H 原子
C.在该过程中,N原子和H原子形成了含有非极性键的NH3
D.合成氨反应中,反应物断键吸收的能量大于生成物形成新键释放的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三草酸合铁酸钾K3[Fe(C2O4)3]·3H2O是一种翠绿色晶体,在日光下照射,会因感光而部分变深蓝色,故常用于工程制图,即“蓝图”。K3[Fe(C2O4)3]·3H2O的制备反应为:2FeC2O4·2H2O + H2O2 + 3K2C2O4 + H2C2O4 = 2K3[Fe(C2O4)3]·3H2O。
回答下列问题:
(1)上述氧化过程中,Fe(II)_____(答简化电子排布式)变为Fe(III)______(答外围电子排布图),基态Fe(III)电子占据______个不同轨道。
(2)对上述反应式中的短周期元素按照电负性由小到大排序为______。
(3)配合物K3[Fe(C2O4)3]的配位数为6,其配体C2O42—中的C的杂化方式为____杂化。
(4) H2O2属于______(填“极性”或“非极性”)分子。H2O2为二元弱酸,一级电离产物HO2—的立体构型是__________。H2O2沸点(150.2 ℃)比H2S沸点(-60.4 ℃)高,简要解释主要原因___________。
(5)将下列晶体的微粒配位数由大到小排序为________(填写代号)
① 金刚石;② 金属钾;③ 干冰
(6)FeO的晶胞结构为NaCl型,测知FeO晶胞边长为428pm,则此晶体中最近的Fe2+与Fe2+的距离为_________pm。(保留三位有效数字)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂空气充电电池有望成为电动汽车的实用储能设备。工作原理示意图如下,下列叙述正确的是
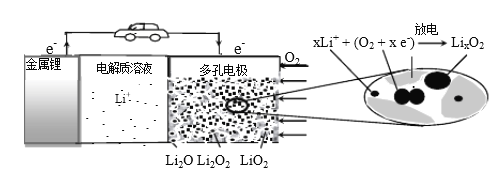
A. 该电池工作时Li+向负极移动
B. Li2SO4溶液可作该电池电解质溶液
C. 电池充电时间越长,电池中Li2O 含量越多
D. 电池工作时,正极可发生: 2Li+ +O2+ 2e-=Li2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷及其化合物有着广泛的用途。砷有两种常见的弱酸,砷酸(H3AsO4)和亚砷酸(H3AsO3)。已知砷酸(H3AsO4)的pKa1、pKa2、pKa3依次为2.25、6.77、11.40(pKa=-lgKa)。回答下列问题:
(1)已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+![]() O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
As(s)+![]() O2(g)=
O2(g)=![]() As2O5(s) ΔH3
As2O5(s) ΔH3
则反应As2O5(s)+3H2O(l)=2H3AsO4(s) ΔH=______。
(2)写出砷酸(H3AsO4)的第二步电离方程式_______。
(3)NaH2AsO4溶液呈___(填“酸性”“中性”或“碱性”),试通过计算说明_______。
(4)亚砷酸(H3AsO3)水溶液中存在多种微粒形态,各种微粒分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与溶液的pH关系如图所示。
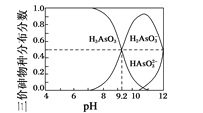
以酚酞为指示剂(变色范围pH 8.2~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为_______。
(5)某化学兴趣小组同学欲探究可逆反应:AsO33-+I2+2OH-![]() AsO43-+2I-+H2O。设计图Ⅱ所示装置。实验操作及现象:按图Ⅱ装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图Ⅱ装置左边烧杯中逐滴加入一定量2 mol·L-1盐酸,发现又产生电流,实验中电流与时间的关系如图Ⅲ所示。
AsO43-+2I-+H2O。设计图Ⅱ所示装置。实验操作及现象:按图Ⅱ装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图Ⅱ装置左边烧杯中逐滴加入一定量2 mol·L-1盐酸,发现又产生电流,实验中电流与时间的关系如图Ⅲ所示。
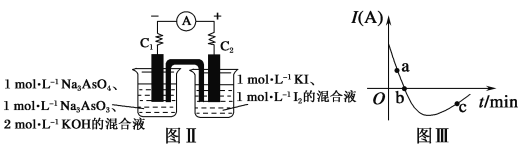
①图Ⅲ中AsO43-的逆反应速率:a__(填“>”“<”或“=”)b。
②写出图Ⅲ中c点对应图Ⅱ装置的正极反应式______。
③能判断该反应达到平衡状态的是__。
a 2v(I-)正=v(AsO33-)逆 b 溶液的pH不再变化
c 电流表示数变为零 d 溶液颜色不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国“蛟龙号多次刷新“中国深度”,为我国深海矿物资源的开发奠定了坚实的基础。黄铜矿(主要成分为CuReS2)是海洋矿物中的一种,它是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。请回答下列问题:
(1)“蛟龙”号外壳用特殊的钛合金材料制成,它可以在7000米的深海中承受710吨的重量。下列说法正确的是___。
A.金属钛属于主族元素
B.钛合金强度不是很大
C.制备钛铝合金时可在空气中将两种金属熔化后混合而成
D.已知金属钛能与H2O反应,可用电解熔融二氧化钛冶炼金属钛
(2)利用黄铜矿冶炼铜的反应为8CuReS2+21O2![]() 8Cu+4FeO+2Fe2O3+16SO2若CuReS2中Fe的化合价为+2,反应中被还原的元素是___。(填元素符号),生成1molFe2O3时转移电子的物质的量为___。
8Cu+4FeO+2Fe2O3+16SO2若CuReS2中Fe的化合价为+2,反应中被还原的元素是___。(填元素符号),生成1molFe2O3时转移电子的物质的量为___。
(3)利用黄铜矿冶炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3)可制备Fe2O3,方法为①用过量稀盐酸浸取炉渣,过滤。②先将滤液氰化,再向其中加入过量NaOH溶液,过滤,将沉淀洗涤、干燥、煆烧得Fe2O3。据以上信息回答下列问题:
a.①中过滤的目的是___,过滤需要的仪器有___。
b.除去A13+的化学方程式为___。
c.②中将滤液氧化常常选用H2O2,其反应的离子方程式为___。
(4)将Cu放入0.1molL-1FeCl3溶液中,反应一定时间后取出Cu片,溶液中c(Fe3+):c(Fe2+)=2:3,则Cu2+与Fe3+的物质的量之比为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾常用作有机合成的氧化剂和催化剂等。由含铬废液(主要含Cr3+、Fe3+、K+、SO42-等)制备K2Cr2O7的流程如图所示。

已知:i.在酸性条件下,H2O2能将Cr2O72-还原为Cr3+。
ii.相关金属离子形成氢氧化物沉淀的pH范围如下:
金属离子 | Fe3+ | Cr3+ |
开始沉淀的pH | 1.5 | 4.9 |
沉淀完全的pH | 2.8 | 6.8 |
回答下列问题:
(1)滤渣①的主要成分为_________(填化学式)。
(2)"氧化”步骤中发生反应的离子方程式为____________。
(3)“加热"操作的目的是_________。
(4)“酸化"过程中发生的反应为2CrO42- +2H+![]() Cr2O72-+ H2O (K=4.0×1014L3·mol -3)。已知“酸化”后溶液(pH=1)中c(Cr2O72- )=6. 4×10-3 mol·L-1,则溶液中c(CrO42-)=_______。
Cr2O72-+ H2O (K=4.0×1014L3·mol -3)。已知“酸化”后溶液(pH=1)中c(Cr2O72- )=6. 4×10-3 mol·L-1,则溶液中c(CrO42-)=_______。
(5)可利用微生物电池将镀铬废水中的Cr2O72-催化还原,其工作原理如图所示:
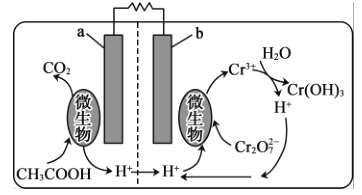
在该电池中,b作______极,a极的电极反应为__________
(6)K2 Cr2O7标准溶液还可用于测定市售硫代硫酸钠晶体(Na2S2O3·5H2O,M=248 g·mol -1)的纯度。测定步骤如下:
i.溶液配制:称取1.2400g市售硫代硫酸钠晶体样品,用新煮沸并冷却的蒸馏水在烧杯中溶解,完全溶解后.全部转移至100mL容量瓶中.加蒸馏水至刻度线。
ii.滴定:取0.01000 mol. L-1的K2Cr2 O7标准溶液20. 00 mL,稀硫酸酸化后加入过量KI溶液,发生反应(Cr2O72-被还原成Cr3+ ,I-被氧化成I2)。然后用硫代硫酸钠样品溶液滴定至淡黄绿色,发生反应:I2+2S2O32 - =S4O62-+2I-。加入淀粉溶液作为指示剂,继续滴定,当溶液蓝色褪去.即为终点。平行滴定3次,样品溶液的平均用量为25.00mL。
①稀硫酸酸化的K2Cr2O7标准溶液与KI溶液反应的离子方程式为_________
②该市售硫代硫酸钠晶体样品的纯度为_______%(保留1位小数)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com