
【题目】锂空气充电电池有望成为电动汽车的实用储能设备。工作原理示意图如下,下列叙述正确的是
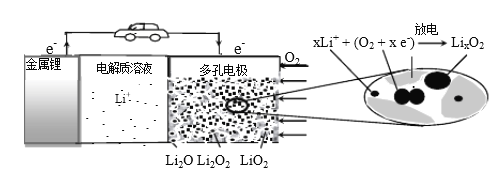
A. 该电池工作时Li+向负极移动
B. Li2SO4溶液可作该电池电解质溶液
C. 电池充电时间越长,电池中Li2O 含量越多
D. 电池工作时,正极可发生: 2Li+ +O2+ 2e-=Li2O2
 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案 A加金题 系列答案
A加金题 系列答案科目:高中化学 来源: 题型:
【题目】国际社会发出落实《巴黎协定》,推动绿色低碳转型,构建人类命运共同体的积极信号。生态工业和循环经济成为综合解决人类资源、环境和经济发展的一条有效途径。
(1)水是“生命之基质”,是“永远值得探究的物质”。
以铂阳极和石墨阴极设计电解池,通过电解NH4HSO4溶液产生(NH4)2S2O8,再与水反应得到H2O2,其中生成的NH4HSO4可以循环使用。
①阳极的电极反应式是__。
②制备H2O2的总反应方程式是__。
(2)CO2的资源化利用能有效减少CO2排放,充分利用碳资源。
CO2催化加氢合成二甲醚是一种CO2转化方法,其过程中主要发生下列反应:
反应Ⅰ:CO2(g)+H2(g)=CO(g)+H2O(g) ΔH=41.2kJ·mol1
反应Ⅱ:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g) ΔH=-122.5kJ·mol1
在恒压、CO2和H2的起始量一定的条件下,CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图。其中:
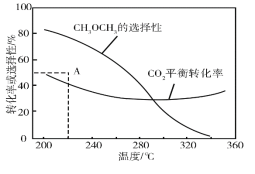
CH3OCH3的选择性=![]() ×100%
×100%
①温度高于300℃,CO2平衡转化率随温度升高而上升的原因是__。
②220℃时,在催化剂作用下CO2与H2反应一段时间后,测得CH3OCH3的选择性为48%(图中A点)。不改变反应时间和温度,一定能提高CH3OCH3选择性的措施有__。
废物再利用。如图装置加以必要的导线连接后达到利用粗铜精炼目的。
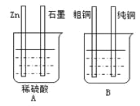
①A烧杯是__(填“电解池”或“原电池”)。
②其中Zn接B烧杯中的__,(填“粗铜”或“纯铜”),B烧杯中应该盛__溶液。
③分别写出石墨棒和纯铜棒的电极反应式
石墨棒:___,
纯铜棒:__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.0.1 mol·L-1 AlCl3溶液中:H+、Na+、Cl-、![]()
B.能使紫色石蕊溶液变蓝的溶液:Ag+、Fe3+、Br-、![]()
C.能使淀粉碘化钾试纸显蓝色的溶液:K+、![]() 、S2-、
、S2-、![]()
D.由水电离产生的c(H+)=10-12 mol·L-1的溶液中:![]() 、
、![]() 、
、![]() 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新型可控电池——锂水电池,工作原理如图所示。下列有关说法不正确的是( )
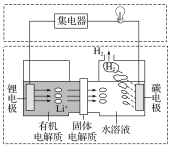
A.碳极发生的反应:2H2O+2e-=H2↑+2OH-
B.有机电解质和水溶液不可以互换区域
C.理论上外电路中每转移1 mol电子,负极消耗的质量为7 g
D.若该电池可以充电,充电时碳极接外加电源的负极,锂极接外加电源的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1) 命名为“2-乙基丙烷”,错误原因是___________;将其命名为“3-甲基丁烷”,错误原因是___________。正确命名为___________。
命名为“2-乙基丙烷”,错误原因是___________;将其命名为“3-甲基丁烷”,错误原因是___________。正确命名为___________。
(2) 的名称为___________________。
的名称为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】单质硼是冶金、建材、化工、核工业等部门的重要原料,而金属镁也广泛应用于航空航天等国防军事工业。以铁硼矿为原料,利用碳碱法工艺生产硼和镁,其工艺流程图如下:
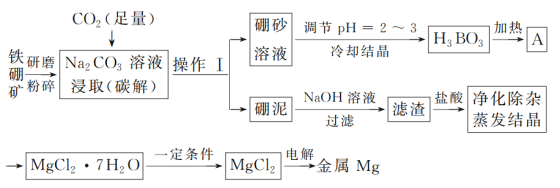
已知:铁硼矿的主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Al2O3和SiO2杂质;硼砂的化学式为Na2B4O7·10H2O。
(1)铁硼矿研磨粉碎的目的是____________;操作Ⅰ的名称为___;硼泥中除杂质SiO2和Al2O3外,其他成分的化学式为_______。
(2)写出流程图中碳解过程的化学方程式:__________;在高温条件下金属Mg与A反应制备单质硼的化学方程式为:__________。
(3)碳碱工艺需两次调节pH:①常用H2SO4调节硼砂溶液pH=2~3制取H3BO3,其离子方程式为B4O72-+2H++5H2O=4H3BO3;②制取MgCl2·7H2O时,在净化除杂过程中,需先加H2O2溶液,其作用是_______,然后用MgO调节pH约为5,其目的是_____。
(4)用MgCl2·7H2O制取MgCl2时,为防止MgCl2水解,反应需在“一定条件下”进行,则该条件是指_____。
(5)实验时不小心触碰到NaOH溶液,可用大量清水冲洗,再涂抹H3BO3溶液中和,其化学方程式为:NaOH+H3BO3=Na[B(OH)4],下列关于Na[B(OH)4]溶液中微粒浓度关系正确的是___。
A c(Na+)+c(H+)=c([B(OH)4]-)+c(OH-)
B c(Na+)>c([B(OH)4]-)>c(H+)>c(OH-)
C c(Na+)=c([B(OH)4]-)+c(H3BO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气、氨气和二氧化硫三种气体均是重要的化工原料且都会对环境造成污染,某课外活动小组拟探究三者的部分性质。
Ⅰ.利用如图装置探究干燥的氯气与氨气之间的反应。
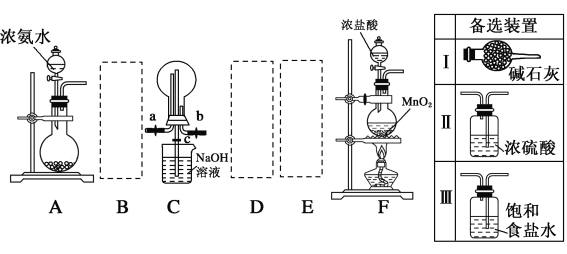
(1)请从备选装置中选择适当的装置连入虚线框中,组成一套完整的探究干燥的氯气与氨气之间的反应的装置,用备选装置序号填空:B___、D__、E__。
(2)装置A中的烧瓶内固体宜选用__(选填以下选项的字母)。
A 烧碱 B 生石灰
C 二氧化硅 D 五氧化二磷
(3)实验时先打开a、c活塞,关闭b活塞,向烧瓶中先通入氨气,然后关闭c活塞,打开b活塞,再向烧瓶中通入氯气,实验中装置C的烧瓶内出现浓厚的白烟并在容器内壁凝结,试推测发生反应的化学方程式为8NH3+3Cl2=6NH4Cl+N2。实验完毕后观察到C烧瓶内还有黄绿色气体,简述如何处理才能不污染环境____________________。
Ⅱ.探究干燥的氯气和SO2的反应:SO2(g)+Cl2(g) SO2Cl2(l) ΔH=-97.3 kJ·mol-1。硫酰氯(SO2Cl2)通常条件下为无色液体,熔点为-54.1 ℃,沸点为69.1 ℃,在潮湿空气中“发烟”,100 ℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。该小组同学用A装置制取SO2,分液漏斗中加入浓硫酸,圆底烧瓶中加入Na2SO3固体,B选择备选装置Ⅱ,将C装置用如图所示的装置甲替换,其余的装置不变来完成探究实验。
SO2Cl2(l) ΔH=-97.3 kJ·mol-1。硫酰氯(SO2Cl2)通常条件下为无色液体,熔点为-54.1 ℃,沸点为69.1 ℃,在潮湿空气中“发烟”,100 ℃以上开始分解,生成二氧化硫和氯气,长期放置也会发生分解。该小组同学用A装置制取SO2,分液漏斗中加入浓硫酸,圆底烧瓶中加入Na2SO3固体,B选择备选装置Ⅱ,将C装置用如图所示的装置甲替换,其余的装置不变来完成探究实验。
(4)装置甲中仪器G的名称为____________,甲中活性炭的作用是____。
(5)如果去掉装置B、D,则在甲的三颈烧瓶中可能发生反应的化学方程式为__________。

(6)为提高本实验中硫酰氯的产率,在实验操作中需要注意的事项有____(填序号)。
A 先通冷凝水,再通气
B 控制气流速率,宜慢不宜快
C 若三颈烧瓶发烫,可适当降温
D 加热三颈烧瓶
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表中前四周期的元素A、B、C、D,原子序数依次增大,且A、B、C同周期。A共有两个原子轨道上有电子,且电子数目相同。B、C相邻,且C中的未成对电子数为3个,D是人类最早使用的元素,并以这种元素命名了一个时代。请回答下面的问题:
(1)A、B、C第一电离能从小到大的顺序为:__________________(填元素符号),D的价层电子排布图为:_______________________。
(2)在不同的温度下,A以ACl2和二聚体 A2Cl4两种形式存在,二聚体的结构式如下图所示:
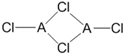
①ACl2中A的杂化方式为_____________。
②1mol A2Cl4中含配位键的数目为_____________。
(3)B元素能形成多种同素异形体,其中一种同素异形体X的晶体结构和晶胞结构如图所示。已知X的密度是a g/cm3,B-B键的键长为r cm,阿伏加德罗常数的值为NA。
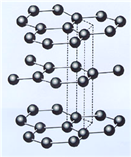
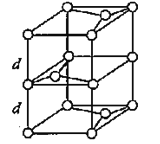
X的晶体结构(左)和晶胞(右)
①X中含有的化学键为____________________。
②X晶体的层间距离为___________________。
(4)C元素可以形成两种含氧酸HCO2和HCO3,酸性是HCO3___HCO2(填“强于”或者“弱于”),原因为__________________________。
(5)将二维密置层在三维空间内堆积,可以得到两种金属晶体的最密堆积方式。一种是按照XYXYXYXY……方式堆积,我们称这种堆积方式为“甲”方式。另外一种是按照XYZXYZXYZXYZ……方式堆积,我们称这种堆积方式为“乙”方式。则金属D的堆积方式为_______。(填“甲”或“乙”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.2mol·L-1H2A溶液中滴加0.2mol.L-1NaOH溶液,溶液中微粒H2A、HA-、A2-的物质的量的变化曲线如图所示。下列说法错误的是
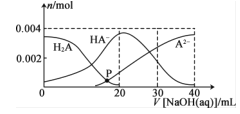
A.当V[NaOH(aq)]=20 mL时.c(OH- )=c(H+ )+c(HA- )+2c(H2A)
B.在P点时,c(Na+ )+c(H+ )=c(OH- )+c(HA- ) +c(A2- )+c(H2A)
C.当V[NaOH(aq)]=30 mL时,2c(Na+ )=3[c(HA- )+c(A2- )+c(H2A)]
D.当V[NaOH(aq)]=40 mL.时.c(Na+ )>c(A2- )>c(OH- )>c(HA- )>c(H2A)>c(H+)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com