
【题目】FeCl2是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水FeCl2。有关物质的性质如下:
C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H4Cl2、苯,易溶于乙醇,易吸水 | ||
熔点/℃ | -45 | 53 | 易升华 | |
沸点/℃ | 132 | 173 | ---------------------- | -------------------- |
(1)H2还原无水FeCl3制取FeCl2。有关装置如图:
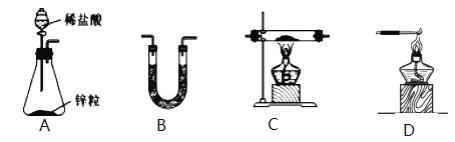
①H2还原无水FeCl3制取FeCl2的化学方程式为_____。
②按气流由左到右的方向,上述仪器的连接顺序为_____。(填字母,装置可多次使用);B中盛放的试剂是_____。
③该制备装置的缺点为_____。
(2)利用反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl↑,制取无水FeCl2并测定FeCl3的转化率。按如图装置,在三颈烧瓶中放入32.5g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。

①仪器a的作用是_____。
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是_____,回收滤液中C6H5C1的操作是_____。
③反应后将锥形瓶中溶液配成250mL,量取25.00mL所配溶液,用0.40mol/L NaOH溶液滴定,终点时消耗NaOH溶液为19.60mL,则氯化铁的转化率为_____。
④为了减少实验误差,在制取无水FeCl2过程中应采取的措施有:_____(写出一点即可)。
【答案】H2+2FeCl3![]() 2FeCl2+2HCl ABCBD 碱石灰 氯化铁易升华导致导管易堵塞 冷凝回流、导气 苯 蒸馏滤液,并收集沸点132℃的馏分 78.4% 反应开始前先通N2一段时间,反应完成后继续通N2一段时间,在装置A和B之间连接一个装有无水氯化钙(或P2O5或硅胶)的球形干燥管
2FeCl2+2HCl ABCBD 碱石灰 氯化铁易升华导致导管易堵塞 冷凝回流、导气 苯 蒸馏滤液,并收集沸点132℃的馏分 78.4% 反应开始前先通N2一段时间,反应完成后继续通N2一段时间,在装置A和B之间连接一个装有无水氯化钙(或P2O5或硅胶)的球形干燥管
【解析】
(1)H2还原无水FeCl3制取FeCl2.用A装置氢气,用B装置中的碱石灰干燥氢气,干燥后的氢气与无水FeCl3在C中发生反应:H2+2FeCl3![]() 2FeCl2+2HCl,为防止外界空气中的水蒸气进入C装置,C之后再连接一个B,最后用C装置处理尾气,该装置的缺点是氯化铁易升华导致导管易堵塞,据此分析作答;
2FeCl2+2HCl,为防止外界空气中的水蒸气进入C装置,C之后再连接一个B,最后用C装置处理尾气,该装置的缺点是氯化铁易升华导致导管易堵塞,据此分析作答;
(2)在A三颈烧瓶中放入32.5g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,发生反应:2FeCl3+C6H5Cl![]() 2FeCl2+3C6H4Cl2+HCl,反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、用苯洗涤、干燥后,得到粗产品,将滤液蒸馏,收集沸点132℃的馏分,回收C6H5C1,为了减少实验误差,反应开始前先通N2一段时间,反应完成后继续通N2一段时间,在装置A和B之间连接一个装有无水氯化钙(或P2O5或硅胶)的球形干燥管,据此分析作答。
2FeCl2+3C6H4Cl2+HCl,反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、用苯洗涤、干燥后,得到粗产品,将滤液蒸馏,收集沸点132℃的馏分,回收C6H5C1,为了减少实验误差,反应开始前先通N2一段时间,反应完成后继续通N2一段时间,在装置A和B之间连接一个装有无水氯化钙(或P2O5或硅胶)的球形干燥管,据此分析作答。
(1)①H2还原无水FeCl3制取FeCl2的反应为:H2+2FeCl3![]() 2FeCl2+2HCl;
2FeCl2+2HCl;
②根据分析,流程为:用A装置氢气,用B装置干燥氢气,干燥后的氢气与无水FeCl3在C中发生反应,为防止外界空气中的水蒸气进入C装置,C之后再连接一个B,最后用D装置处理尾气,故连接顺序为:ABCBD;B的目的是干燥吸水,盛放的试剂是碱石灰;
③根据题意氯化铁易升华,故该制备装置可能会因为氯化铁易升华导致导管易堵塞;
(2)①仪器a为球形冷凝管,其作用为冷凝回流、导气;
②反应结束后,冷却实验装置A,三颈烧瓶内物质主要是产物FeCl2,还有多余的氯苯和副产物C6H4Cl2,由题可知,氯苯和副产物C6H4Cl2溶于苯,FeCl2不溶于苯,故洗涤所用的试剂可以是苯,减少产品的损失;滤液的溶质有氯苯和C6H4Cl2,有表可知,二者沸点相差较大,可用蒸馏的方法分离,故回收滤液中C6H5C1的操作方法是蒸馏滤液,并收集沸点132℃的馏分;
③32.5g无水氯化铁理论上生成的n(FeCl2)=n(FeCl3)=![]() =0.2mol,HCl消耗标准液NaOH为0. 0196L×0.4mol/L=0.00784mol,故反应生成的n(FeCl2)=2(HCl)=2×0.00784mol×
=0.2mol,HCl消耗标准液NaOH为0. 0196L×0.4mol/L=0.00784mol,故反应生成的n(FeCl2)=2(HCl)=2×0.00784mol×![]() =0.1568mol,故氯化铁的转化率为
=0.1568mol,故氯化铁的转化率为![]() ×100%=78.4%;
×100%=78.4%;
④为防止FeCl2被装置中的空气氧化,可以反应开始前先通N2一段时间,反应完成后继续通N2一段时间,为防止产物水解,可以在装置A和B之间连接一个装有无水氯化钙(或P2O5或硅胶)的球形干燥管。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】氨广泛用于生产化肥、制冷剂等方面。回答下列问题:
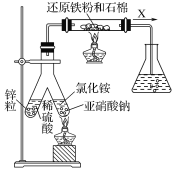
(1)实验室可用上图所示装置合成氨。
①亚硝酸钠与氯化铵反应的离子方程式为NO2-+NH4+![]() N2↑+2H2O。
N2↑+2H2O。
②锥形瓶中盛有一定量水并滴有几滴酚酞试剂。反应一段时间后,锥形瓶中溶液变红,则气体X的成分为N2、水蒸气、________和________(填化学式)。
(2)最近斯坦福大学研究人员发明了一种SUNCAT的锂循环系统,可持续合成氨,其原理如图所示。

①图中反应Ⅱ属于________(填“氧化还原反应”或“非氧化还原反应”)。
②反应Ⅲ中能量转化的方式是________(填“电能转变为化学能”或“化学能转变为电能”)。
(3)液氨可用作制冷剂,液氨汽化时________(填“释放”或“吸收”)能量;液氨泄漏遇明火会发生爆炸。已知部分化学键的键能数据如下表所示:
共价键 | N-H | O=O | N≡N | O-H |
键能/kJ·mol-1 | 391 | 498 | 946 | 463 |
则反应4NH3(g)+3O2(g)=2N2(g)+6H2O(g)的反应热ΔH=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酮洛芬是优质抗炎镇痛药,合成原理如下:
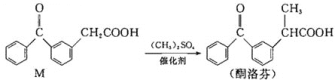
下列说法正确的是( )
A.M和酮洛芬都能发生酯化、卤代和加成反应
B.M和酮洛芬分子中所有碳原子都可能共平面
C.M和酮洛芬在一定条件下最多消耗![]() 的物质的量相等
的物质的量相等
D.M分子中苯环上一氯代物有9种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,用0.10mol/L的盐酸分别滴定体积相同且浓度均为0.10mol/L的三种一元碱XOH、YOH及ZOH,滴定曲线如图所示。

下列说法正确的是
A. 滴定XOH时可用酚酞作指示剂
B. YOH是强碱
C. X++H2O![]() XOH+H+的平衡常数K=10-4
XOH+H+的平衡常数K=10-4
D. [V(盐酸)/V(碱)]=0.5时,c(Z+)>c(Y+)>c(X+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔、乙烯均是重要的化工原料。回答下列问题:
(1)1902年,Sabatier首次发现,常压下过渡金属可以催化含有双键或叁键的气态烃的加氢反应。
①已知:C2H2(g)+H2(g)═C2H4(g)△H1=-174.3kJ·mol—1
K1(300K)=3.37×1024
C2H2(g)+2H2(g)=C2H6(g)△H2═-311.0kJ·mol一l
K2(300K)═1.19×1042
则反应C2H4(g)+H2(g)═C2H6(g)的△H=___kJ·mol一1,K(300K)=__(保留三位有效数字)。
②2010年Sheth等得出乙炔在Pd表面选择加氢的反应机理(如图)。其中吸附在Pd表面上的物种用*标注。

上述吸附反应为____(填“放热”或“吸热”)反应,该历程中最大能垒(活化能)为____kJ·mol-1,该步骤的化学方程式为____。
(2)在恒容密闭容器中充入乙烯,一定条件下发生反应C2H4(g)C2H2(g)+H2(g)。乙烯的离解率为a,平衡时容器内气体总压强为P总,则分压p(C2H4)═___(用p总和a表示)。
(3)用如图装置电解含CO2的某酸性废水溶液,阴极产物中含有乙烯。

该分离膜为___(填“阳”或“阴”)离子选择性交换膜;生成乙烯的电极反应式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,下列各组离子在指定溶液中一定能大量共存的是( )
A.0.1 mol·L-1 AlCl3溶液中:H+、Na+、Cl-、![]()
B.能使紫色石蕊溶液变蓝的溶液:Ag+、Fe3+、Br-、![]()
C.能使淀粉碘化钾试纸显蓝色的溶液:K+、![]() 、S2-、
、S2-、![]()
D.由水电离产生的c(H+)=10-12 mol·L-1的溶液中:![]() 、
、![]() 、
、![]() 、Cl-
、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定某有机物A的结构,做如下实验:
①将2.3 g该有机物完全燃烧,生成0.1 mol CO2和2.7 g水;
②用质谱仪测得其相对分子质量为46;
③用核磁共振仪处理该化合物,得到如下图所示谱图,图中三个峰的面积之比是1:2:3。

试回答下列问题:
(1)有机物A的实验式是___________。
(2)能否根据A的实验式确定A的分子式?____________(填“能”或“不能”);若能,则A的分子式是___________;若不能,则此空不填。
(3)写出有机物A可能的结构简式:__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1) 命名为“2-乙基丙烷”,错误原因是___________;将其命名为“3-甲基丁烷”,错误原因是___________。正确命名为___________。
命名为“2-乙基丙烷”,错误原因是___________;将其命名为“3-甲基丁烷”,错误原因是___________。正确命名为___________。
(2) 的名称为___________________。
的名称为___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SPC(2Na2CO33H2O2具有Na2CO3和H2O2的双重性质,广泛应用于印染、医药卫生等领域。以芒硝(Na2SO410H2O)、H2O2等为原料制备SPC的工艺流程如下:
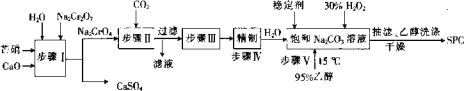
回答下列问题:
(1)步骤I中_____(填“有”或“没有”)发生氧化还原反应。
(2)步骤II中会生成一种可以循环使用的物质,该物质的化学式为_____。
(3)步骤Ⅲ中需要加热,发生反应的化学方程式为______。
(4)步骤Ⅳ中,合成时需选择温度为15℃,其目的是_____,从环境保护的角度看,诙流程中存在的缺点是_______。
(5)SPC的保存方法是________。
(6)过氧化氢用催化剂催化分解时生成水和氧原子,该氧原子非常活泼,称为活性氧。称量0.1600 g样品, 置于250 mL锥形瓶中,并用100 mL 0. 5 molL-1硫酸溶解完全,立即用0.02000molL-1KMnO4标准溶液滴定,滴定至终点时溶液颜色为_____,且半分钟内不恢复为原来的颜色,进行三次平行实验,消耗KMnO4溶液的平均体积为26.56 mL。另外,在不加样品的情况下按照上述过程进行空白实验,消耗KMnO4溶液的平均体积为2.24 mL。该样品的活性氧含量为______%。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com