
【题目】氨广泛用于生产化肥、制冷剂等方面。回答下列问题:
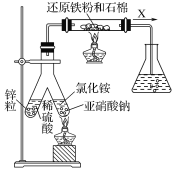
(1)实验室可用上图所示装置合成氨。
①亚硝酸钠与氯化铵反应的离子方程式为NO2-+NH4+![]() N2↑+2H2O。
N2↑+2H2O。
②锥形瓶中盛有一定量水并滴有几滴酚酞试剂。反应一段时间后,锥形瓶中溶液变红,则气体X的成分为N2、水蒸气、________和________(填化学式)。
(2)最近斯坦福大学研究人员发明了一种SUNCAT的锂循环系统,可持续合成氨,其原理如图所示。

①图中反应Ⅱ属于________(填“氧化还原反应”或“非氧化还原反应”)。
②反应Ⅲ中能量转化的方式是________(填“电能转变为化学能”或“化学能转变为电能”)。
(3)液氨可用作制冷剂,液氨汽化时________(填“释放”或“吸收”)能量;液氨泄漏遇明火会发生爆炸。已知部分化学键的键能数据如下表所示:
共价键 | N-H | O=O | N≡N | O-H |
键能/kJ·mol-1 | 391 | 498 | 946 | 463 |
则反应4NH3(g)+3O2(g)=2N2(g)+6H2O(g)的反应热ΔH=________。
【答案】H2 NH3 非氧化还原反应 电能转变为化学能 吸收 -1262kJ·mol-1
【解析】
(1)①合成氨时Fe作反应的催化剂;
②锥形瓶中溶液变红,可知有氨气生成,且为可逆反应;
(2)①图中反应Ⅱ为Li3N与H2O反应生成氨气;
②反应Ⅲ中LiOH电解生成Li、氧气和水;
(3)液氨气化吸收热量,且焓变等于化学键断裂吸收的能量减去成键释放的能量。
(1)①亚硝酸钠具有强氧化性与氯化铵发生氧化还原反应,生成氮气,反应的离子方程式为NO2-+NH4+![]() N2↑+2H2O;
N2↑+2H2O;
②锌与稀硫酸反应生成的氢气与亚硝酸钠和氯化铵反应生成的氮气在催化剂作用下反应生成了氨气,因此锥形瓶中酚酞溶液变红,则气体X的成分为N2、水蒸气、H2、NH3;
(2)①反应Ⅱ是Li3N与水反应生成氨气的过程,反应中没有元素化合价的变化,属于非氧化还原反应;
②反应Ⅲ中氢氧化锂转变为锂、氧气和水,发生了氧化还原反应,属于非自发的氧化还原反应,属于电解池反应,能量转化的方式是电能转变为化学能;
(3)液氨可用作制冷剂,是因为液氨气化时吸收能量,导致周围温度降低;反应4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH=反应物的键能之和-生成物的键能之和=391×3×4+498×3-946×2-463×2×6 kJ·mol-1=-1 262 kJ·mol-1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是( )
A.HCO3-在水溶液中的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B.H2SO3的电离方程式H2SO3![]() 2H++SO32-
2H++SO32-
C.CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D.CaCO3的电离方程式:CaCO3Ca2++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴的碳酸盐及SiO2杂质)为原料生产金属锰的工艺流程如下:
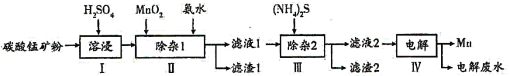
已知25℃时,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | Fe(OH)3 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.1×10-36 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步骤I中,为加快溶浸速率,可采取的措施是__________(至少答两条)。
(2)步骤II中,加氨水调节溶液的pH为5.0~6.0,则滤渣1的成分主要为________(填化学式);已知MnO2的作用为氧化剂,“除杂1”中涉及的离子方程式为NH3·H2O+H+=NH4++H2O、_____________、___________。
(3)步骤中,所加(NH4)2S的浓度不宜过大的原因是______________。
(4)滤液2中,c(Co2+):c(Ni2+)=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
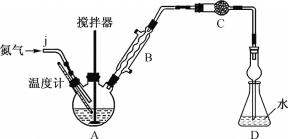
【题目】无水FeCl2易吸湿、易被氧化,常作为超高压润滑油的成分。某实验小组利用无水FeCl3和氯苯(无色液体,沸点132.2℃)制备少量无水FeCl2,并测定无水FeCl2的产率。
实验原理:2FeCl3+C6H5Cl![]() 2FeCl2+C6H4Cl2+HCl↑
2FeCl2+C6H4Cl2+HCl↑
实验装置:按如图所示组装好的装置,检查气密性后,向三颈烧瓶A中加入16.76g无水FeCl3和22.5g氯苯。
回答下列问题:
(1)利用工业氮气(含有H2O、O2、CO2)制取纯净干燥的氮气。
①请从下列装置中选择必要的装置,确定其合理的连接顺序:a→________→上图中的j口(按气流方向,用小写字母表示)。
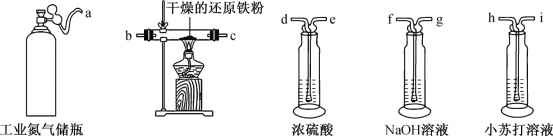
②实验完成后通入氮气的主要目的是________。
(2)装置C中的试剂是________(填试剂名称),其作用是________。
(3)启动搅拌器,在约126℃条件下剧烈搅拌30min,物料变成黑色泥状。加热装置A最好选用__(填字母)。
a.酒精灯 b.水浴锅 c.电磁炉 d.油浴锅
(4)继续升温,在128~139℃条件下加热2h,混合物颜色逐渐变浅,黏度降低。该步骤中加热温度已经接近或超过氯苯沸点,但氯苯实际损失量却非常小,其原因是________。
(5)继续加热1h后放置冷却,在隔绝空气条件下过滤出固体,用洗涤剂多次洗涤所得固体,置于真空中干燥,得到成品。若D中所得溶液恰好与25mL2.0mol·L-1NaOH溶液完全反应,则该实验中FeCl2的产率约为________(保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家研发出一种新型水溶液锂电池,采用复合膜包裹的金属锂作负极,锰酸锂(LiMn2O4)作正极,以0.5 mol/Li2SO4 水溶液作电解质溶液。电池充、放电时,LiMn2O4与Li2Mn2O4可以相互转化。下列有关该电池的说法正确的是
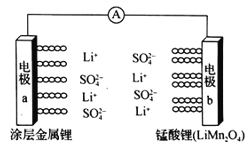
A. 该电池放电时,溶液中的SO42-向电极b移动
B. 该电池负极的电极反应式为:2Li+2H2O==2LiOH+H2↑
C. 电池充电时,外加直流电源的正极与电极a相连
D. 电池充电时,阳极的电极反应式为:Li2Mn2O4-e-==LiMn2O4 +Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.标准状况下,等物质的量的C2H4和CH4所含的氢原子数均为4NA
B.1L0.4mol/L亚硫酸钠溶液中H2SO3、HSO3-、SO32-的总数为0.4NA
C.向含4molFeI2的溶液中通入等物质的量的Cl2,转移的电子数为4NA
D.100g98%的硫酸与磷酸的混合溶液中含氧原子数为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯磺酸(HSO3Cl)是无色液体,密度为1.79gcm-3,其沸点约152℃:氯磺酸有强腐蚀性,遇潮湿空气生成浓烈的白雾,它属于危险品。制取氯碘酸是在常温下将干燥的氯化氢气体通入溶有三氧化硫的硫酸(发烟硫酸)中,氯化氢与三氧化硫化合即得氯磺酸。在实验室里制取氯磺酸可用如图所示的装置(图中衬垫、夹持和固定仪器均已略去)。
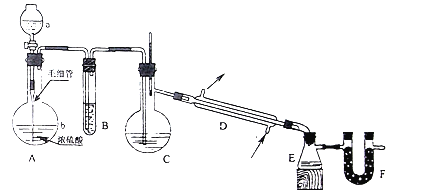
所用到的试剂有:①密度为1.19gcm-3的浓盐酸;②密度为1.84gcm-3质量分数为98.3%的浓硫酸(98.3%的浓硫酸沸点是338℃;③发烟硫酸;④无水氯化钙:⑤水;⑥碱石灰。试填空:
(1)对应仪器中应盛入的试剂或药品(填名称):
a中为______,B中为______,C中为______,F中为______;
(2)A中的分液漏斗下端接有的毛细管的作用是:______,若不用毛细管直接用分液漏斗注入a中液体,可能发生的现象是______,利用生活用品改进实验装置,若将分液漏斗换为______,还能更好的控制反应发生;
(3)写出实验室制备氯磺酸的化学方程式______,一定程度时需用酒精灯在C装置下加热的作用是:______;
(4)如果C中的温度计换成温度传感器,作用是:______;
(5)如果不加F装置可能产生大量烟雾,用化学用语解释原因______;
(6)若F中加无水氯化钙,F后______(填有或没有)必要加装HCl的吸收装置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象与实验操作不相匹配的是
实验操作 | 实验现象 | |
A | 向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 | 溶液的紫色逐渐褪去,静置后溶液分层 |
B | 将镁条点燃后迅速伸入集满CO2的集气瓶 | 集气瓶中产生浓烟并有黑色颗粒产生 |
C | 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 | 有刺激性气味气体产生,溶液变浑浊 |
D | 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 | 黄色逐渐消失,加KSCN后溶液颜色不变 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl2是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水FeCl2。有关物质的性质如下:
C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H4Cl2、苯,易溶于乙醇,易吸水 | ||
熔点/℃ | -45 | 53 | 易升华 | |
沸点/℃ | 132 | 173 | ---------------------- | -------------------- |
(1)H2还原无水FeCl3制取FeCl2。有关装置如图:
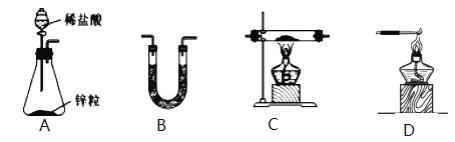
①H2还原无水FeCl3制取FeCl2的化学方程式为_____。
②按气流由左到右的方向,上述仪器的连接顺序为_____。(填字母,装置可多次使用);B中盛放的试剂是_____。
③该制备装置的缺点为_____。
(2)利用反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl↑,制取无水FeCl2并测定FeCl3的转化率。按如图装置,在三颈烧瓶中放入32.5g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。

①仪器a的作用是_____。
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是_____,回收滤液中C6H5C1的操作是_____。
③反应后将锥形瓶中溶液配成250mL,量取25.00mL所配溶液,用0.40mol/L NaOH溶液滴定,终点时消耗NaOH溶液为19.60mL,则氯化铁的转化率为_____。
④为了减少实验误差,在制取无水FeCl2过程中应采取的措施有:_____(写出一点即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com