
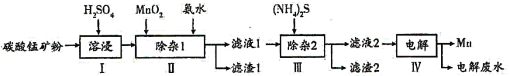
【题目】锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴的碳酸盐及SiO2杂质)为原料生产金属锰的工艺流程如下:
已知25℃时,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | Fe(OH)3 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.1×10-36 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步骤I中,为加快溶浸速率,可采取的措施是__________(至少答两条)。
(2)步骤II中,加氨水调节溶液的pH为5.0~6.0,则滤渣1的成分主要为________(填化学式);已知MnO2的作用为氧化剂,“除杂1”中涉及的离子方程式为NH3·H2O+H+=NH4++H2O、_____________、___________。
(3)步骤中,所加(NH4)2S的浓度不宜过大的原因是______________。
(4)滤液2中,c(Co2+):c(Ni2+)=____________。
【答案】溶浸时加热(或升高温度)、适当增大硫酸浓度、搅拌、减小矿粉颗粒直径等 SiO2、Fe(OH)3 2Fe2++MnO2+4H+=2Fe3++Mn2++2H2O Fe3++3NH3·H2O=Fe(OH)3↓+3NH4+ 若(NH4)2S的浓度过大,产生MnS沉淀造成产品损失 5:1
【解析】
向碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)中加入硫酸,可以发生反应生成硫酸盐,向其中就如具有氧化性的二氧化锰,可以将亚铁离子氧化为铁离子,调节pH可以将氢氧化铁沉淀下来,向滤液中加入硫化铵,可以将镍离子、钴离子形成硫化物沉淀下来,最后对得到的含有锰离子的盐电解,可以得到金属锰。
(1)搅拌固体和液体的混合物,升高温度、增大浓度等,可加快反应速率,所以为了提高浸取率可采取的措施有加热或搅拌或增大硫酸浓度等;
(2)步骤Ⅱ中,MnO2在酸性条件下可将Fe2+离子氧化为Fe3+,反应的离子方程式MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,加入氨水调节pH为5.0~6.0,发生Fe3++3NH3﹒H2O=Fe(OH)3↓+3NH4+,可得到沉淀Fe(OH)3,另外原矿物中含有的SiO2不溶于酸和氨水,则过滤时所得滤渣1的主要成分为SiO2、Fe(OH)3;
(3)向滤液中滴入适量的(NH4)2S溶液,目的是除去Cu2+、Zn2+,若(NH4)2S的浓度过大,产生MnS沉淀,造成产品损失;
(4)CoS、NiS的Ksp分别为5.0×10-22、1.0×10-22,加入足量(NH4)2S溶液后,生成CoS、NiS沉淀,溶液中c(Co2+):c(Ni2+)=5.0×10-22:1.0×10-22=5:1。


科目:高中化学 来源: 题型:
【题目】空气中有丰富的氮气,科学家展开了向空气要氨气的系列研究。
(1)已知:2H2(g)+O2(g)=2H2O(l) ΔH=a kJ·mol-1
N2(g)+O2(g) =2NO(g) ΔH=b kJ·mol-1
4NH3(g)+5O2(g) =4NO(g)+6H2O(l) ΔH=c kJ·mol-1
工业上合成氨反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH= _______ kJ·mol-1
2NH3(g) ΔH= _______ kJ·mol-1
(2)以悬浮的纳米Fe2O3作催化剂,H2O和N2为原料直接常压电化学合成氨方面取得了突破性进展。其工作原理如图所示:
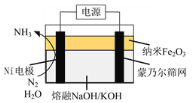
①Ni电极处发生的总反应为: N2+6e-+6H2O=2NH3+6OH-
已知该反应分为两步,其中第二步的反应为2Fe+3H2O+N2=2NH3+Fe2O3,则第一步反应为 _______ 。
②蒙乃尔筛网处发生的电极反应为: _______ 。
(3)NH3可以合成尿素,反应为2NH3(g)+CO2(g)![]() CO(NH2)2(g)+H2O(g)。向一体积可变的恒压容器中充入一定量的NH3和CO2,保持容器的温度不变,NH3和CO2的转化率随时间的变化如图所示。
CO(NH2)2(g)+H2O(g)。向一体积可变的恒压容器中充入一定量的NH3和CO2,保持容器的温度不变,NH3和CO2的转化率随时间的变化如图所示。
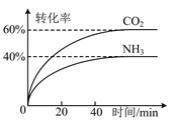
①下列情况能说明反应达到平衡状态的是 _______ 。
A NH3和CO2的物质的量之比为2∶1
B 容器内气体的密度保持不变
C 2v正(NH3)=v逆(CO2)
D 各气体的体积分数保持不变
②起始时NH3和CO2的物质的量之比为 _______ 。
③维持容器的温度和压强不变,向上述平衡后的容器中充入NH3(g)、CO(NH2)2(g)和H2O(g)各1 mol,则达到新平衡时NH3的体积分数为 _______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酰氧基胡椒酚乙酸酯(F)具有抗氧化性、抗肿瘤作用,其合成路线如下:
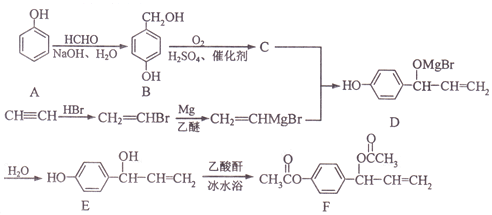
已知:RMgBr![]()
(1)化合物F中含氧官能团的名称为______。
(2)A-B的反应类型为_______。
(3)化合物C的结构简式为______。
(4)1mol化合物E与足量乙酸酐[(CH3CO)2O]反应,除F外另一产物的物质的量为_______。
(5)写出同时满足下列条件的E的一种同分异构体的结构简式:________。
①能与FeCl3溶液发生显色反应; ②能发生银镜反应;
③核磁共振氢谱显示有4种不同化学环境的氢,其峰面积比为6:2:1:1。
(6)请以甲苯和乙醛为原料制备![]() ,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______________
,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用0.100 mol·L-1 AgNO3滴定50.0 mL 0.0500 mol·L-1 Cl-溶液的滴定曲线如图所示。下列有关描述错误的是

A. 根据曲线数据计算可知Ksp(AgCl)的数量级为10-10
B. 曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=Ksp(AgCl)
C. 相同实验条件下,若改为0.0400 mol·L-1 Cl-,反应终点c移到a
D. 相同实验条件下,若改为0.0500 mol·L-1 Br-,反应终点c向b方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验中,能达到相应实验目的的是
|
|
|
|
A.制备并收集乙酸乙酯 | B.证明氯化银溶解度大于硫化银 | C.验证溴乙烷的消去产物是乙烯 | D.推断S、C、Si的非金属性强弱 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知25℃时,CaCO3饱和溶液中c(Ca2+)为5.3×10-5 mol·L-1 MgCO3的饱和溶液中c(Mg2+)为2.6×10-3 mol·L-1。若在5 mL浓度均为0.01 mol·L-1的CaCl2和MgCl2溶液中,逐滴加入5 mL 0.012 mol·L-1 Na2CO3溶液,充分反应后过滤得到溶液M和沉淀N(不考虑溶液体积的变化)。下列观点不正确的是
A.25℃时,Ksp(CaCO3)=2.8×10-9
B.加入Na2CO3溶液的过程中,先生成CaCO3沉淀
C.滤液M中:c(Cl-)>c(Na+)>c(Mg2+)>c(CO32-)>c(OH-)
D.滤液M中:![]() =
=
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯氧磷(POCl3)广泛用于农药、医药等生产。工业制备三氯氧磷的过程中会产生副产品亚磷酸(H3PO3)。请回答下列问题:
(1)三氯氧磷可由三氯化磷、水、氯气加热反应生成,反应的化学方程式为__________。
(2)已知亚磷酸(H3PO3)为二元弱酸,则Na2HPO3溶液中,各离子浓度的大小关系为_______。
(3)常温下,将NaOH溶液滴加到亚磷酸(H3PO3)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。则表示lg![]() 的是曲线______(填“I”或“II”),亚磷酸(H3PO3)的Kal=________,反应HPO32-+H2O
的是曲线______(填“I”或“II”),亚磷酸(H3PO3)的Kal=________,反应HPO32-+H2O![]() H2PO3-+OH-的平衡常数值是____________。
H2PO3-+OH-的平衡常数值是____________。
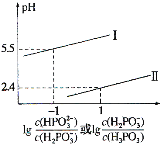
(4)工业上生产三氯氧磷的同时会产生含磷废水(主要成分为H3PO4、H3PO3)。向废水中先加入适量漂白粉,再加入生石灰调节pH,将磷元素转化为磷酸的钙盐沉淀并回收。若处理后的废水中c(Ca2+)=5×10-6 mol·L-1,则溶液中c(PO43-)=________mol·L-1。(已知Ksp[Ca3(PO4)2]=2×10-29)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨广泛用于生产化肥、制冷剂等方面。回答下列问题:
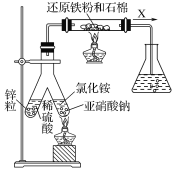
(1)实验室可用上图所示装置合成氨。
①亚硝酸钠与氯化铵反应的离子方程式为NO2-+NH4+![]() N2↑+2H2O。
N2↑+2H2O。
②锥形瓶中盛有一定量水并滴有几滴酚酞试剂。反应一段时间后,锥形瓶中溶液变红,则气体X的成分为N2、水蒸气、________和________(填化学式)。
(2)最近斯坦福大学研究人员发明了一种SUNCAT的锂循环系统,可持续合成氨,其原理如图所示。

①图中反应Ⅱ属于________(填“氧化还原反应”或“非氧化还原反应”)。
②反应Ⅲ中能量转化的方式是________(填“电能转变为化学能”或“化学能转变为电能”)。
(3)液氨可用作制冷剂,液氨汽化时________(填“释放”或“吸收”)能量;液氨泄漏遇明火会发生爆炸。已知部分化学键的键能数据如下表所示:
共价键 | N-H | O=O | N≡N | O-H |
键能/kJ·mol-1 | 391 | 498 | 946 | 463 |
则反应4NH3(g)+3O2(g)=2N2(g)+6H2O(g)的反应热ΔH=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酮洛芬是优质抗炎镇痛药,合成原理如下:
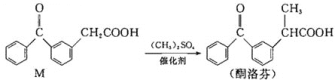
下列说法正确的是( )
A.M和酮洛芬都能发生酯化、卤代和加成反应
B.M和酮洛芬分子中所有碳原子都可能共平面
C.M和酮洛芬在一定条件下最多消耗![]() 的物质的量相等
的物质的量相等
D.M分子中苯环上一氯代物有9种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com