
【题目】酮洛芬是优质抗炎镇痛药,合成原理如下:
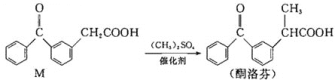
下列说法正确的是( )
A.M和酮洛芬都能发生酯化、卤代和加成反应
B.M和酮洛芬分子中所有碳原子都可能共平面
C.M和酮洛芬在一定条件下最多消耗![]() 的物质的量相等
的物质的量相等
D.M分子中苯环上一氯代物有9种
科目:高中化学 来源: 题型:
【题目】锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴的碳酸盐及SiO2杂质)为原料生产金属锰的工艺流程如下:
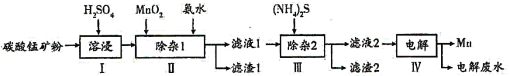
已知25℃时,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | Fe(OH)3 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.1×10-36 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步骤I中,为加快溶浸速率,可采取的措施是__________(至少答两条)。
(2)步骤II中,加氨水调节溶液的pH为5.0~6.0,则滤渣1的成分主要为________(填化学式);已知MnO2的作用为氧化剂,“除杂1”中涉及的离子方程式为NH3·H2O+H+=NH4++H2O、_____________、___________。
(3)步骤中,所加(NH4)2S的浓度不宜过大的原因是______________。
(4)滤液2中,c(Co2+):c(Ni2+)=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯磺酸(HSO3Cl)是无色液体,密度为1.79gcm-3,其沸点约152℃:氯磺酸有强腐蚀性,遇潮湿空气生成浓烈的白雾,它属于危险品。制取氯碘酸是在常温下将干燥的氯化氢气体通入溶有三氧化硫的硫酸(发烟硫酸)中,氯化氢与三氧化硫化合即得氯磺酸。在实验室里制取氯磺酸可用如图所示的装置(图中衬垫、夹持和固定仪器均已略去)。
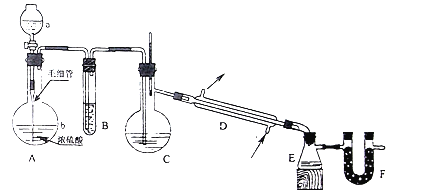
所用到的试剂有:①密度为1.19gcm-3的浓盐酸;②密度为1.84gcm-3质量分数为98.3%的浓硫酸(98.3%的浓硫酸沸点是338℃;③发烟硫酸;④无水氯化钙:⑤水;⑥碱石灰。试填空:
(1)对应仪器中应盛入的试剂或药品(填名称):
a中为______,B中为______,C中为______,F中为______;
(2)A中的分液漏斗下端接有的毛细管的作用是:______,若不用毛细管直接用分液漏斗注入a中液体,可能发生的现象是______,利用生活用品改进实验装置,若将分液漏斗换为______,还能更好的控制反应发生;
(3)写出实验室制备氯磺酸的化学方程式______,一定程度时需用酒精灯在C装置下加热的作用是:______;
(4)如果C中的温度计换成温度传感器,作用是:______;
(5)如果不加F装置可能产生大量烟雾,用化学用语解释原因______;
(6)若F中加无水氯化钙,F后______(填有或没有)必要加装HCl的吸收装置。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象与实验操作不相匹配的是
实验操作 | 实验现象 | |
A | 向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 | 溶液的紫色逐渐褪去,静置后溶液分层 |
B | 将镁条点燃后迅速伸入集满CO2的集气瓶 | 集气瓶中产生浓烟并有黑色颗粒产生 |
C | 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 | 有刺激性气味气体产生,溶液变浑浊 |
D | 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 | 黄色逐渐消失,加KSCN后溶液颜色不变 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用酸解法制钛白粉产生的废液[含有大量的FeSO4、H2SO4和少量的Fe2(SO4)3、TiOSO4]生产铁红和补血剂乳酸亚铁的工艺流程如图所示:
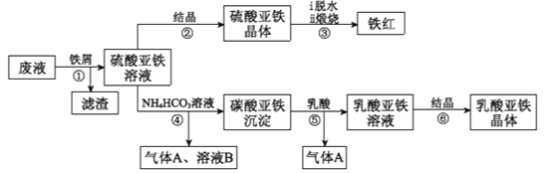
已知:TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-,TiO2+水解成TiO2·xH2O沉淀为可逆反应;乳酸结构简式为CH3CH(OH)COOH。
回答下列问题:
(1)TiOSO4中钛元素的化合价是____________,步骤①中分离硫酸亚铁溶液和滤渣的操作是___________。
(2)滤渣的主要成分为TiO2·xH2O,结合离子方程式解释得到滤渣的原因:________。
(3)从硫酸亚铁溶液中得到硫酸亚铁晶体的操作方法是____________________;硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应的氧化剂和还原剂的物质的量之比为______。
(4)步骤④中发生反应的离子方程式为______________________。
(5)步骤⑥必须控制一定的真空度,原因是有利于蒸发水以及____________________。
(6)实验室中检验溶液B中主要阳离子的方法是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由—CH3、—COOH、—OH、![]() 四种基团中的两种组成的化合物中,与过量的NaOH溶液发生反应,反应后向所得产物中再通入二氧化碳也能反应的物质的种类有
四种基团中的两种组成的化合物中,与过量的NaOH溶液发生反应,反应后向所得产物中再通入二氧化碳也能反应的物质的种类有
A.1种B.2种
C.3种D.4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四溴化钛(TiBr4)可用作橡胶工业中烯烃聚合反应的催化剂。已知TiBr4常温下为橙黄色固体,熔点为38.3℃,沸点为233.5℃,具有潮解性且易发生水解。实验室利用反应TiO2+C+2Br2![]() TiBr4+CO2制备TiBr4的装置如图所示。回答下列问题:
TiBr4+CO2制备TiBr4的装置如图所示。回答下列问题:
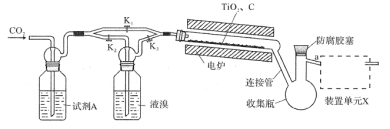
(1)检查装置气密性并加入药品后,加热前应进行的操作是__,其目的是__,此时活塞K1,K2,K3的状态为__;一段时间后,打开电炉并加热反应管,此时活塞K1,K2,K3的状态为____。
(2)试剂A为__,装置单元X的作用是__;反应过程中需用热源间歇性微热连接管,其目的是___。
(3)反应结束后应继续通入一段时间CO2,主要目的是___。
(4)将连接管切断并熔封,采用蒸馏法提纯。此时应将a端的仪器改装为__、承接管和接收瓶,在防腐胶塞上加装的仪器是___(填仪器名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】FeCl2是一种常用的还原剂、媒染剂。某化学实验小组在实验室里用如下两种方法来制备无水FeCl2。有关物质的性质如下:
C6H5Cl(氯苯) | C6H4Cl2(二氯苯) | FeCl3 | FeCl2 | |
溶解性 | 不溶于水,易溶于苯、乙醇 | 不溶于C6H5Cl、C6H4Cl2、苯,易溶于乙醇,易吸水 | ||
熔点/℃ | -45 | 53 | 易升华 | |
沸点/℃ | 132 | 173 | ---------------------- | -------------------- |
(1)H2还原无水FeCl3制取FeCl2。有关装置如图:
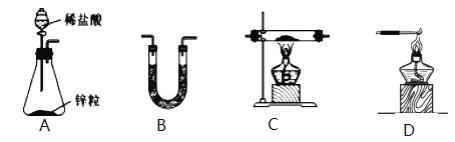
①H2还原无水FeCl3制取FeCl2的化学方程式为_____。
②按气流由左到右的方向,上述仪器的连接顺序为_____。(填字母,装置可多次使用);B中盛放的试剂是_____。
③该制备装置的缺点为_____。
(2)利用反应2FeCl3+C6H5Cl→2FeCl2+C6H4Cl2+HCl↑,制取无水FeCl2并测定FeCl3的转化率。按如图装置,在三颈烧瓶中放入32.5g无水氯化铁和过量的氯苯,控制反应温度在一定范围加热3h,冷却、分离提纯得到粗产品。

①仪器a的作用是_____。
②反应结束后,冷却实验装置A,将三颈烧瓶内物质倒出,经过滤、洗涤、干燥后,得到粗产品。洗涤所用的试剂可以是_____,回收滤液中C6H5C1的操作是_____。
③反应后将锥形瓶中溶液配成250mL,量取25.00mL所配溶液,用0.40mol/L NaOH溶液滴定,终点时消耗NaOH溶液为19.60mL,则氯化铁的转化率为_____。
④为了减少实验误差,在制取无水FeCl2过程中应采取的措施有:_____(写出一点即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷及其化合物有着广泛的用途。砷有两种常见的弱酸,砷酸(H3AsO4)和亚砷酸(H3AsO3)。已知砷酸(H3AsO4)的pKa1、pKa2、pKa3依次为2.25、6.77、11.40(pKa=-lgKa)。回答下列问题:
(1)已知:As(s)+![]() H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+2O2(g)=H3AsO4(s) ΔH1
H2(g)+![]() O2(g)=H2O(l) ΔH2
O2(g)=H2O(l) ΔH2
As(s)+![]() O2(g)=
O2(g)=![]() As2O5(s) ΔH3
As2O5(s) ΔH3
则反应As2O5(s)+3H2O(l)=2H3AsO4(s) ΔH=______。
(2)写出砷酸(H3AsO4)的第二步电离方程式_______。
(3)NaH2AsO4溶液呈___(填“酸性”“中性”或“碱性”),试通过计算说明_______。
(4)亚砷酸(H3AsO3)水溶液中存在多种微粒形态,各种微粒分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与溶液的pH关系如图所示。
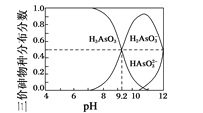
以酚酞为指示剂(变色范围pH 8.2~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加。该过程中主要反应的离子方程式为_______。
(5)某化学兴趣小组同学欲探究可逆反应:AsO33-+I2+2OH-![]() AsO43-+2I-+H2O。设计图Ⅱ所示装置。实验操作及现象:按图Ⅱ装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图Ⅱ装置左边烧杯中逐滴加入一定量2 mol·L-1盐酸,发现又产生电流,实验中电流与时间的关系如图Ⅲ所示。
AsO43-+2I-+H2O。设计图Ⅱ所示装置。实验操作及现象:按图Ⅱ装置加入试剂并连接装置,电流由C2流入C1。当电流变为零时,向图Ⅱ装置左边烧杯中逐滴加入一定量2 mol·L-1盐酸,发现又产生电流,实验中电流与时间的关系如图Ⅲ所示。
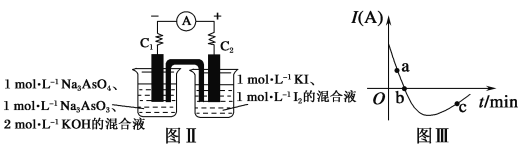
①图Ⅲ中AsO43-的逆反应速率:a__(填“>”“<”或“=”)b。
②写出图Ⅲ中c点对应图Ⅱ装置的正极反应式______。
③能判断该反应达到平衡状态的是__。
a 2v(I-)正=v(AsO33-)逆 b 溶液的pH不再变化
c 电流表示数变为零 d 溶液颜色不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com