
【题目】空气中有丰富的氮气,科学家展开了向空气要氨气的系列研究。
(1)已知:2H2(g)+O2(g)=2H2O(l) ΔH=a kJ·mol-1
N2(g)+O2(g) =2NO(g) ΔH=b kJ·mol-1
4NH3(g)+5O2(g) =4NO(g)+6H2O(l) ΔH=c kJ·mol-1
工业上合成氨反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH= _______ kJ·mol-1
2NH3(g) ΔH= _______ kJ·mol-1
(2)以悬浮的纳米Fe2O3作催化剂,H2O和N2为原料直接常压电化学合成氨方面取得了突破性进展。其工作原理如图所示:
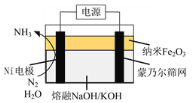
①Ni电极处发生的总反应为: N2+6e-+6H2O=2NH3+6OH-
已知该反应分为两步,其中第二步的反应为2Fe+3H2O+N2=2NH3+Fe2O3,则第一步反应为 _______ 。
②蒙乃尔筛网处发生的电极反应为: _______ 。
(3)NH3可以合成尿素,反应为2NH3(g)+CO2(g)![]() CO(NH2)2(g)+H2O(g)。向一体积可变的恒压容器中充入一定量的NH3和CO2,保持容器的温度不变,NH3和CO2的转化率随时间的变化如图所示。
CO(NH2)2(g)+H2O(g)。向一体积可变的恒压容器中充入一定量的NH3和CO2,保持容器的温度不变,NH3和CO2的转化率随时间的变化如图所示。
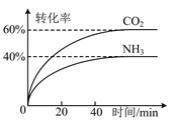
①下列情况能说明反应达到平衡状态的是 _______ 。
A NH3和CO2的物质的量之比为2∶1
B 容器内气体的密度保持不变
C 2v正(NH3)=v逆(CO2)
D 各气体的体积分数保持不变
②起始时NH3和CO2的物质的量之比为 _______ 。
③维持容器的温度和压强不变,向上述平衡后的容器中充入NH3(g)、CO(NH2)2(g)和H2O(g)各1 mol,则达到新平衡时NH3的体积分数为 _______ 。
【答案】(b+![]() -
-![]() ) Fe2O3+6e-+3H2O=2Fe+6OH- 4OH--4e-=2H2O+O2↑ BD 3∶1 52.94%
) Fe2O3+6e-+3H2O=2Fe+6OH- 4OH--4e-=2H2O+O2↑ BD 3∶1 52.94%
【解析】
(1)可根据盖斯定理由已知反应求得目标反应的焓变;
(2)观察其工作原理图可知,Ni电极变化为N2→NH3,发生还原反应,是阴极,则蒙乃尔筛网处是阳极,发生氧化反应。
(3)①反应达到平衡状态时,正逆反应速率相等,各组分的浓度保持不变及由此衍生的其他物理量进行分析;
②设起始时NH3和CO2的物质的量分别为n(NH3)、n(CO2),反应消耗的CO2的物质的量为x,结合方程式列三段式,结合氨气、二氧化碳的转化率进行分析计算,求出n(NH3):n(CO2);
③维持容器的温度和压强不变,向上述平衡后的容器中充入NH3(g)、CO(NH2)2(g)和H2O(g)各1 mol,进行转化,通过把生成物全部转化为反应物后,可知转化后比值相等,与原平衡等效,则达到新平衡时NH3的体积分数与原平衡相同,所以,只需计算原平衡中NH3的体积分数即可。
(1)由已知:①2H2(g)+O2(g)=2H2O(l) ΔH=a k·mol-1
②N2(g)+O2(g) =2NO(g) ΔH=b k·mol-1
③4NH3(g)+5O2(g) =4NO(g)+6H2O(l) ΔH=c k·mol-1
根据盖斯定理,可由①×![]() +②-③×
+②-③×![]() 得反应:N2(g)+3H2(g)
得反应:N2(g)+3H2(g) ![]() 2NH3(g),则ΔH= (b+
2NH3(g),则ΔH= (b+![]() -
-![]() )k·mol-1。答案为:(b+
)k·mol-1。答案为:(b+![]() -
-![]() )
)
(2)①用总反应减第二步的反应得:Fe2O3+6e-+3H2O=2Fe+6OH-。答案为:Fe2O3+6e-+3H2O=2Fe+6OH-
②蒙乃尔筛网处是阳极,OH-放电,发生氧化反应:4OH--4e-=2H2O+O2↑。答案为:4OH--4e-=2H2O+O2↑
(3)①A. NH3和CO2的物质的量之比为2∶1时不一定达到平衡,A选项错误;
B. 反应体系条件为恒温恒压,平衡移动,气体物质的量变化,所以气体体积也变化,而体系气体质量不变,所以密度会随平衡的移动而变化,密度不变时反应达到平衡状态,B选项正确;
C. 由2v正(NH3)=v逆(CO2),得v正(NH3):v逆(CO2)=1:2,不等于计量数之比,反应没有达到平衡状态,C选项错误;
D. 根据化学平衡状态的定义,平衡时各组分的百分含量保持不变,D选项正确;
答案为:BD
②设起始时NH3和CO2的物质的量分别为n(NH3)、n(CO2),反应消耗的CO2的物质的量为x,则有:
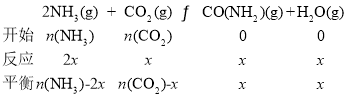
![]() ,
,![]()
解得:![]()
答案为:3∶1
③维持容器的温度和压强不变,向上述平衡后的容器中充入NH3(g)、CO(NH2)2(g)和H2O(g)各1 mol,进行转化:
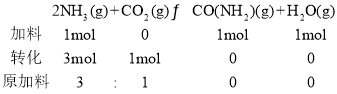
转化后比值相等,与原平衡等效,则达到新平衡时NH3的体积分数与原平衡相同,所以,只需计算原平衡中NH3的体积分数即可。
在②的计算中,n(NH3)=3n(CO2),x=0.6 n(CO2),则平衡时总物质的量为n(NH3)- 2x+ n(CO2)-x+ x + x = n(NH3)+ n(CO2)-x=3.4 n(CO2),则达到新平衡时NH3的体积分数为:
![]()
答案为:52.94%


科目:高中化学 来源: 题型:
【题目】镍的全球消费量仅次于铜、铝、铅、锌,居有色金属第五位,常用于各种高光泽装饰漆和塑料生产,也用作催化剂,制取原理:Ni(CO)4(g)![]() Ni(s)+4CO(g),实验室用如图所示装置制取 Ni(CO)4。
Ni(s)+4CO(g),实验室用如图所示装置制取 Ni(CO)4。

已知:CO + PdCl2 + H2O = CO2 + Pd↓(黑色) + 2HCl;Ni(CO)4 熔点-25℃,沸点 43℃,60℃以上与空气混合易爆炸;Fe(CO)5 熔点-20℃,沸点 103℃。回答下列问题:
(1)装置 A 中发生反应的化学方程式为_____。
(2)装置 C 用于合成 Ni(CO)4(夹持装置略),最适宜选用的装置为________(填标号)。
①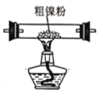 ②
②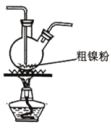 ③
③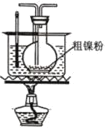
(3)实验过程中为了防止_________,必须先观察________(填实验现象)再加热 C 装置。
(4)利用“封管实验”原理可获得(高纯镍。如图所示的石英)玻璃封管中充有 CO 气体,则高纯镍粉在封管的________温度区域端生成 填“323K”或“473K” 。

(5)实验中加入 11.50 g HCOOH,C 装置质量减轻 2.95 g(设杂质不参加反应),E 装置中盛有 PdCl2 溶液100 mL,则 PdCl2 溶液的物质的量浓度至少为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮元素是一种重要的非金属元素,可形成多种化合物。试回答下列有关问题:
(1)①已知4CO(g)+2NO2(g) ![]() 4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1对于该反应,改变某一反应条件,(已知温度T2>T1)下列图像正确的是_______(填代号)
4CO2(g)+N2(g) ΔH=-1 200 kJ·mol-1对于该反应,改变某一反应条件,(已知温度T2>T1)下列图像正确的是_______(填代号)

②已知CO与H2O在一定条件下可以发生反应:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH= - Q kJ·mol-1 ,820 ℃时在甲、乙两个恒容密闭容器中,起始时按照下表进行投料,经过一段时间后达到平衡状态,若甲中CO的转化率为40%,则该反应的平衡常数为____________;乙容器吸收的热量为________________。
CO2(g)+H2(g) ΔH= - Q kJ·mol-1 ,820 ℃时在甲、乙两个恒容密闭容器中,起始时按照下表进行投料,经过一段时间后达到平衡状态,若甲中CO的转化率为40%,则该反应的平衡常数为____________;乙容器吸收的热量为________________。
![]()
(2)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气,已知:
① N2 (g) +2O2 (g) = N2O4 (l) ΔH =-19.5 kJ·mol-1
② N2H4(l)+O2(g) = N2(g) +2H2O(g) ΔH =-534.2 kJ·mol-1
写出肼与四氧化二氮反应的热化学方式______________。
(3)纯的叠氮酸(HN3)是无色液体,常用做引爆剂,常温下向25 mL 0.1mol·L-1 NaOH溶液中加入0. 2mol·L-1 HN3的溶液,滴加过程中的pH值的变化曲线(溶液混合时的体积变化忽略不计)如图。

①根据图像写出HN3的电离方程式:_________。
②下列说法正确的是_________________(填序号)
A.若用已知浓度的NaOH溶液滴定HN3溶液来测定HN3的浓度时应用甲基橙作指示剂
B.常温下,向0.2 mol·L-1 HN3的溶液中加水稀释,则![]() 不变
不变
C.分别中和pH均为4的HN3溶液和HCl溶液,消耗0.1 mol·L-1 NaOH溶液的体积相同
D.D点时溶液中离子浓度存在如下关系:2c(H+) + c(HN3) =c(N3-) + 2c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用浓度相同的氯水、Cl2的CCl4溶液完成下述实验。下列有关实验的说法中,不正确的是
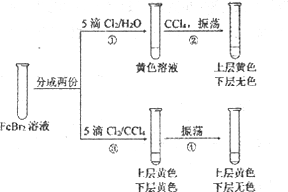
A. 操作④中发生的反应是Br2+ 2Fe2+=2Br-+2Fe3+
B. 操作②和操作④之后,试管上层溶液的成分相同
C. 操作①后的溶液中没有Br2,但反应过程中可能有Br2生成
D. 实验说明,CCl4影响了Cl2、Br2和Fe3+氧化性的强弱顺序
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得结论正确的是
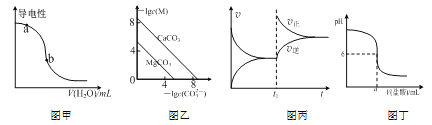
A.图甲表示一定温度下,CH3COOH稀溶液加水时溶液的导电性变化,则pH(a)>pH(b)
B.图乙表示一定温度下,MCO3(M:Mg2+、Ca2+)的沉淀溶解平衡曲线,则Ksp(MgCO3)<Ksp(CaCO3)
C.图丙表示一定温度下,可逆反应N2(g)+3H2(g) ![]() 2NH3(g)正逆反应速率随时间变化的曲线,t1时改变的条件可能是分离出NH3
2NH3(g)正逆反应速率随时间变化的曲线,t1时改变的条件可能是分离出NH3
D.图丁表示常温下将0.1 mol·L-1盐酸溶液滴加到a mL0.1 mol·L-1BOH溶液中,所得溶液pH随所加入盐酸溶液体积的变化图,则BOH为弱碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取纯净![]() 固体用如下方法制备
固体用如下方法制备![]() 。
。
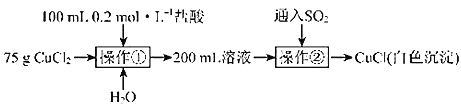
(4)操作②中反应的离子方程式为_________。
(5)操作①中若用![]() 盐酸代替
盐酸代替![]() 盐酸,再通入
盐酸,再通入![]() 后,无白色沉淀产生。对此现象有如下两种猜想:
后,无白色沉淀产生。对此现象有如下两种猜想:
猜想一:![]() 过大导致白色沉淀溶解。为验证此猜想,取75gCuCl2固体、
过大导致白色沉淀溶解。为验证此猜想,取75gCuCl2固体、![]() 盐酸及________
盐酸及________![]() 配制
配制![]() 溶液,再进行操作②,观察是否有白色沉淀产生。
溶液,再进行操作②,观察是否有白色沉淀产生。
猜想二:____________。为验证此猜想,取少量白色沉淀加入饱和氯化钠溶液中,搅拌,观察白色沉淀是否溶解。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知草酸是二元弱酸,0.2 mol·L-1NaHC2O4溶液显酸性,关于NaHC2O4溶液中离子浓度关系的叙述不正确的是( )
A.c(Na+)>c(HC2O4—)>c(C2O42—)>c(H2C2O4)
B.c(Na+)=c(HC2O4—)+c(C2O42—)+c(H2C2O4)
C.c(Na+)+c(H+)=c(HC2O4—)+c(C2O42—)+c(OH-)
D.c(H+)+c(H2C2O4)=c(C2O42—)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列方程式书写正确的是( )
A.HCO3-在水溶液中的电离方程式:HCO3-+H2O![]() H3O++CO32-
H3O++CO32-
B.H2SO3的电离方程式H2SO3![]() 2H++SO32-
2H++SO32-
C.CO32-的水解方程式:CO32-+2H2O![]() H2CO3+2OH-
H2CO3+2OH-
D.CaCO3的电离方程式:CaCO3Ca2++CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴的碳酸盐及SiO2杂质)为原料生产金属锰的工艺流程如下:
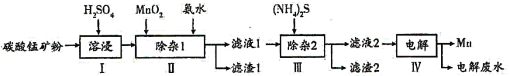
已知25℃时,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | Fe(OH)3 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.1×10-36 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步骤I中,为加快溶浸速率,可采取的措施是__________(至少答两条)。
(2)步骤II中,加氨水调节溶液的pH为5.0~6.0,则滤渣1的成分主要为________(填化学式);已知MnO2的作用为氧化剂,“除杂1”中涉及的离子方程式为NH3·H2O+H+=NH4++H2O、_____________、___________。
(3)步骤中,所加(NH4)2S的浓度不宜过大的原因是______________。
(4)滤液2中,c(Co2+):c(Ni2+)=____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com