
【题目】镍的全球消费量仅次于铜、铝、铅、锌,居有色金属第五位,常用于各种高光泽装饰漆和塑料生产,也用作催化剂,制取原理:Ni(CO)4(g)![]() Ni(s)+4CO(g),实验室用如图所示装置制取 Ni(CO)4。
Ni(s)+4CO(g),实验室用如图所示装置制取 Ni(CO)4。

已知:CO + PdCl2 + H2O = CO2 + Pd↓(黑色) + 2HCl;Ni(CO)4 熔点-25℃,沸点 43℃,60℃以上与空气混合易爆炸;Fe(CO)5 熔点-20℃,沸点 103℃。回答下列问题:
(1)装置 A 中发生反应的化学方程式为_____。
(2)装置 C 用于合成 Ni(CO)4(夹持装置略),最适宜选用的装置为________(填标号)。
①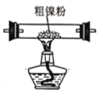 ②
②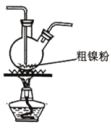 ③
③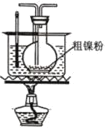
(3)实验过程中为了防止_________,必须先观察________(填实验现象)再加热 C 装置。
(4)利用“封管实验”原理可获得(高纯镍。如图所示的石英)玻璃封管中充有 CO 气体,则高纯镍粉在封管的________温度区域端生成 填“323K”或“473K” 。

(5)实验中加入 11.50 g HCOOH,C 装置质量减轻 2.95 g(设杂质不参加反应),E 装置中盛有 PdCl2 溶液100 mL,则 PdCl2 溶液的物质的量浓度至少为________mol·L-1。
【答案】HCOOH H2O+CO↑ ③ CO 及 Ni(CO)4 与装置中空气混合在加热条件下爆炸 E 装置中产生黑色沉淀 473K 0.50
H2O+CO↑ ③ CO 及 Ni(CO)4 与装置中空气混合在加热条件下爆炸 E 装置中产生黑色沉淀 473K 0.50
【解析】
A装置中甲酸和浓硫酸反应生成CO,经B装置中浓硫酸进行干燥,根据方程式Ni(CO)4(g)![]() Ni(s)+4CO(g),温度在50~80℃是更有利于Ni(CO)4的生成,为了更好的控制温度可选用水浴加热,Ni(CO)4的沸点为43℃,所以反应生成的Ni(CO)4会变成气体,在D装置中进行冷凝得到Ni(CO)4液体,之后利用E装置吸收未反应的CO,同时为了防止Ni(CO)4与空气混合加热,需先通一段时间的CO,通过观察E装置中是否有黑色成生成可判断装置中是否充满CO。
Ni(s)+4CO(g),温度在50~80℃是更有利于Ni(CO)4的生成,为了更好的控制温度可选用水浴加热,Ni(CO)4的沸点为43℃,所以反应生成的Ni(CO)4会变成气体,在D装置中进行冷凝得到Ni(CO)4液体,之后利用E装置吸收未反应的CO,同时为了防止Ni(CO)4与空气混合加热,需先通一段时间的CO,通过观察E装置中是否有黑色成生成可判断装置中是否充满CO。
(1)装置A中甲酸与在浓硫酸的作用下生成CO和水,反应方程式为HCOOH H2O+CO↑;
H2O+CO↑;
(2)温度在50~80℃是更有利于Ni(CO)4的生成,为了更好的控制温度,且可避免温度过高,可选用水浴加热,所以选用③装置;
(3)CO 及 Ni(CO)4 与装置中空气混合在加热条件下会发生爆炸,所以要先观察到E装置中生成黑色沉淀,再加热C装置;
(4)323K是49.85℃,473K是199.85℃,根据方程式Ni(CO)4 (g)![]() Ni(s)+4CO(g)可知180~200℃时生成Ni单质,所以高纯镍粉在封管的473K温度区域端生成;
Ni(s)+4CO(g)可知180~200℃时生成Ni单质,所以高纯镍粉在封管的473K温度区域端生成;
(5)n(HCOOH)=![]() =0.25mol,则生成的n(CO)=0.25mol,C装置中发生Ni(s)+4CO(g)
=0.25mol,则生成的n(CO)=0.25mol,C装置中发生Ni(s)+4CO(g)![]() Ni(CO)4(g),则C管减轻的质量即反应的Ni的质量,则反应n(Ni)=
Ni(CO)4(g),则C管减轻的质量即反应的Ni的质量,则反应n(Ni)=![]() =0.05mol,则消耗n(CO)=0.2mol,所以PdCl2 溶液至少要吸收CO的物质的量为0.25mol-0.2mol=0.05mol,根据方程式CO + PdCl2 + H2O = CO2 + Pd↓(黑色) + 2HCl可知所需n(PdCl2)=0.05mol,所以其浓度至少为
=0.05mol,则消耗n(CO)=0.2mol,所以PdCl2 溶液至少要吸收CO的物质的量为0.25mol-0.2mol=0.05mol,根据方程式CO + PdCl2 + H2O = CO2 + Pd↓(黑色) + 2HCl可知所需n(PdCl2)=0.05mol,所以其浓度至少为![]() =0.5mol/L。
=0.5mol/L。


科目:高中化学 来源: 题型:
【题目】在一体积固定的密闭容器中加入反应物A、B,发生如下反应:A(g)+2B(g)![]() 3C(g)。反应过程中的部分数据如下表所示:下列说法正确的是( )
3C(g)。反应过程中的部分数据如下表所示:下列说法正确的是( )
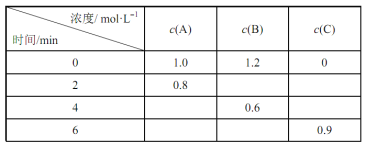
A.在0~2min内,B的反应速率为0.1mol·Lˉ1·minˉ1
B.2min时,C的物质的量浓度为0.4mol·L-1
C.4min时,反应已达到平衡状态,此时正、逆反应的速率都为0
D.在4~6min内,容器内气体分子的总物质的量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 向某溶液中先滴加稀硝酸,再滴加 | 该溶液中一定含有 |
B | 向 |
|
C | 向 |
|
D | 用 | 酸性: |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国第二化工设计院提出,用间接电化学法对大气污染物 NO 进行无害化处理,其原理示意如图,下列相关判断正确的是
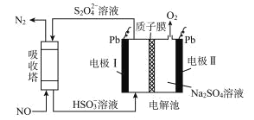
A.电极 I为阴极,电极反应式为 2H2O+2e-=2OH-+H2↑
B.电解池中质子从电极 I 向电极Ⅱ作定向移动
C.每处理 1 mol NO 电解池右侧质量减少 16 g
D.吸收塔中的反应为 2NO+2S2O42-+H2O=N2+4HSO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法不正确的是
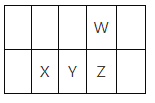
A.原子半径:W<XB.常温常压下,Y单质为固态
C.最高价氧化物对应水化物的酸性:Y<ZD.X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PtCl2(NH3)2可以形成两种固体,一种为淡黄色,在水中的溶解度较小;另一种为黄绿色,在水中的溶解度较大。
(1)PtCl2(NH3)2为__________结构(填“平面四边形”或“四面体”)。
(2)黄绿色固体的立体构型图为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年国际非政府组织“全球碳计划”12月4日发布报告:研究显示,全球二氧化碳排放量增速趋缓。CO2的综合利用是解决温室问题的有效途径。
(1)一种途径是将CO2转化成有机物实现碳循环。如:
C2H4(g)+H2O(l)=C2H5OH(l) ΔH1=-44.2kJ·mol-1
2CO2(g)+2H2O(l)=C2H4(g)+3O2(g) ΔH2=+1411.0kJ·mol-1
2CO2(g)+3H2O(l)=C2H5OH(l)+3O2(g) ΔH3=___。
(2)CO2甲烷化反应是由法国化学家Sabatier提出的,因此,该反应又叫Sabatier反应。CO2催化氢化制甲烷的研究过程如图:
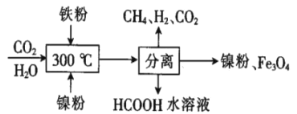
上述过程中,产生H2反应的化学方程式为__。
②HCOOH是CO2转化为CH4的中间体:CO2![]() HCOOH
HCOOH![]() CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,当增加镍粉用量时,CO2镍催化氢化制甲烷的两步反应中反应速率增加较大的一步是__(填“I”或“Ⅱ”)。
CH4。当镍粉用量增加10倍后,甲酸的产量迅速减少,当增加镍粉用量时,CO2镍催化氢化制甲烷的两步反应中反应速率增加较大的一步是__(填“I”或“Ⅱ”)。
(3)CO2经催化加氢可以生成低碳烃,主要有两个竞争反应:
反应I:CO2(g)+4H2(g)![]() CH4(g)+2H2O(g)
CH4(g)+2H2O(g)
反应Ⅱ:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)
C2H4(g)+4H2O(g)
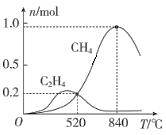
在1L恒容密闭容器中充入1molCO2和4molH2,测得平衡时有关物质的物质的量随温度变化如图所示。520℃时,CO2的转化率为__,520℃时,反应I的平衡常数K=__。
(4)已知CO2催化加氢合成乙醇的反应原理为2CO2(g)+6H2(g)![]() C2H5OH(g)+3H2O(g) ΔH。m代表起始时的投料比,即m=
C2H5OH(g)+3H2O(g) ΔH。m代表起始时的投料比,即m=![]() 。图1中投料比相同,温度T3>T2>T1,则ΔH___(填“>”或“<”)0。
。图1中投料比相同,温度T3>T2>T1,则ΔH___(填“>”或“<”)0。
②m=3时,该反应达到平衡状态后p(总)=20Mpa,恒压条件下各物质的物质的量分数与温度的关系如图2。则曲线b代表的物质为___(填化学式),T4温度时,反应达到平衡时物质d的分压p(d)=___。
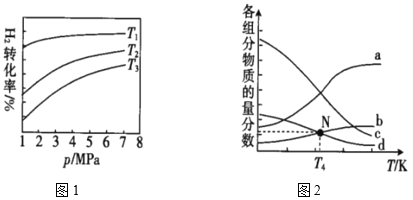
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。回答下列问题:
(1)氮原子价层电子对的轨道表达式(电子排布图)为_____________。
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是___________;氮元素的E1呈现异常的原因是__________。
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如图(b)所示。
①从结构角度分析,R中两种阳离子的相同之处为_________,不同之处为__________。(填标号)
A.中心原子的杂化轨道类型 B.中心原子的价层电子对数
C.立体结构 D.共价键类型
②R中阴离子N5-中的σ键总数为________个。分子中的大π键可用符号![]() 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为![]() ),则N5-中的大π键应表示为____________。
),则N5-中的大π键应表示为____________。
③图(b)中虚线代表氢键,其表示式为(NH4+)N-H┄Cl、____________、____________。

(4)R的晶体密度为d g·cm-3,其立方晶胞参数为a nm,晶胞中含有y个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M,则y的计算表达式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空气中有丰富的氮气,科学家展开了向空气要氨气的系列研究。
(1)已知:2H2(g)+O2(g)=2H2O(l) ΔH=a kJ·mol-1
N2(g)+O2(g) =2NO(g) ΔH=b kJ·mol-1
4NH3(g)+5O2(g) =4NO(g)+6H2O(l) ΔH=c kJ·mol-1
工业上合成氨反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH= _______ kJ·mol-1
2NH3(g) ΔH= _______ kJ·mol-1
(2)以悬浮的纳米Fe2O3作催化剂,H2O和N2为原料直接常压电化学合成氨方面取得了突破性进展。其工作原理如图所示:
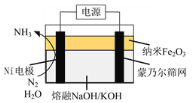
①Ni电极处发生的总反应为: N2+6e-+6H2O=2NH3+6OH-
已知该反应分为两步,其中第二步的反应为2Fe+3H2O+N2=2NH3+Fe2O3,则第一步反应为 _______ 。
②蒙乃尔筛网处发生的电极反应为: _______ 。
(3)NH3可以合成尿素,反应为2NH3(g)+CO2(g)![]() CO(NH2)2(g)+H2O(g)。向一体积可变的恒压容器中充入一定量的NH3和CO2,保持容器的温度不变,NH3和CO2的转化率随时间的变化如图所示。
CO(NH2)2(g)+H2O(g)。向一体积可变的恒压容器中充入一定量的NH3和CO2,保持容器的温度不变,NH3和CO2的转化率随时间的变化如图所示。
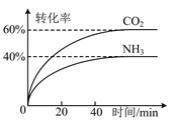
①下列情况能说明反应达到平衡状态的是 _______ 。
A NH3和CO2的物质的量之比为2∶1
B 容器内气体的密度保持不变
C 2v正(NH3)=v逆(CO2)
D 各气体的体积分数保持不变
②起始时NH3和CO2的物质的量之比为 _______ 。
③维持容器的温度和压强不变,向上述平衡后的容器中充入NH3(g)、CO(NH2)2(g)和H2O(g)各1 mol,则达到新平衡时NH3的体积分数为 _______ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com