
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法不正确的是
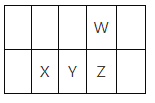
A.原子半径:W<XB.常温常压下,Y单质为固态
C.最高价氧化物对应水化物的酸性:Y<ZD.X的最高价氧化物的水化物是强碱
【答案】D
【解析】
W、X、Y、Z为短周期主族元素,根据图示可知,W位于第二周期,X、Y、Z位于第三周期,设W的最外层电子数为x,则X的最外层电子数为x-2,W、X的最高价分别为x、x-2,W与X 的最高化合价之和为8,则x+x-2=8,解得:x=5,则W为N元素,结合各元素在周期表中相对位置可知,X为Al,Y为Si,Z为P元素,据此解答。
A.电子层越多原子半径越大,则原子半径W<X,故A正确;
B.常温常压下单质硅为固态,故B正确;
C.非金属性Si<P,最高价氧化物对应水化物的酸性:Y(Si)<Z(P),故C正确;
D.X的最高价氧化物的水化物为氢氧化铝,氢氧化铝为弱碱,故D错误;
故选:D。


 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:
【题目】根据能量变化示意图,下列说法正确的是( )

A. 状态1是液态,则状态3一定是气态
B. 状态3是液态,则状态4一定是气态
C. A(状态2)+B(g)═C(状态3)+D(g)△H=(d﹣a)kJmol﹣1
D. 断裂1molC(状态3)和1molD(g)中的化学键需要吸收的能量为(e﹣d)kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作能达到实验目的的是( )


A.用乙醇萃取碘水中的碘B.用装置甲制取纯净的![]()
C.用装置乙除去![]() 中的少量
中的少量![]() D.中和滴定时,用待测液润洗锥形瓶,减小实验误差
D.中和滴定时,用待测液润洗锥形瓶,减小实验误差
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有几组物质的熔点(℃)的数据:
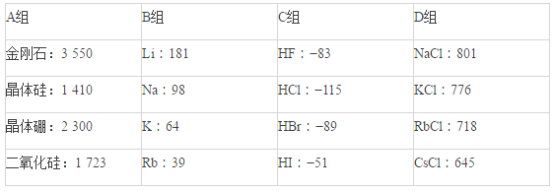
据此回答下列问题:
(1)A组属于___________晶体,其熔化时克服的微粒间的作用力是__________________。
(2)B组晶体共同的物理性质是___________________(填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于_______________________________________。
(4)D组晶体可能具有的性质是_________________(填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)D组晶体的熔点由高到低的顺序为NaCl>KCl>RbCl>CsCl,其原因解释为_______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标明下列反应电子转移情况,并根据要求回答问题。
(1)3NO2+H2O=2HNO3+NO_______
(2)氧化剂____________还原剂____________氧化产物____________还原产物__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镍的全球消费量仅次于铜、铝、铅、锌,居有色金属第五位,常用于各种高光泽装饰漆和塑料生产,也用作催化剂,制取原理:Ni(CO)4(g)![]() Ni(s)+4CO(g),实验室用如图所示装置制取 Ni(CO)4。
Ni(s)+4CO(g),实验室用如图所示装置制取 Ni(CO)4。

已知:CO + PdCl2 + H2O = CO2 + Pd↓(黑色) + 2HCl;Ni(CO)4 熔点-25℃,沸点 43℃,60℃以上与空气混合易爆炸;Fe(CO)5 熔点-20℃,沸点 103℃。回答下列问题:
(1)装置 A 中发生反应的化学方程式为_____。
(2)装置 C 用于合成 Ni(CO)4(夹持装置略),最适宜选用的装置为________(填标号)。
①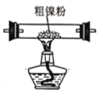 ②
②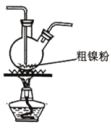 ③
③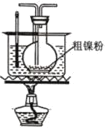
(3)实验过程中为了防止_________,必须先观察________(填实验现象)再加热 C 装置。
(4)利用“封管实验”原理可获得(高纯镍。如图所示的石英)玻璃封管中充有 CO 气体,则高纯镍粉在封管的________温度区域端生成 填“323K”或“473K” 。

(5)实验中加入 11.50 g HCOOH,C 装置质量减轻 2.95 g(设杂质不参加反应),E 装置中盛有 PdCl2 溶液100 mL,则 PdCl2 溶液的物质的量浓度至少为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚苯胺是一种在充放电过程中具有更优异可逆性的电极材料。Zn一聚苯胺二次电池的结构示意图如图所示,设NA为阿伏加德罗常数的值。下列说法错误的是( )
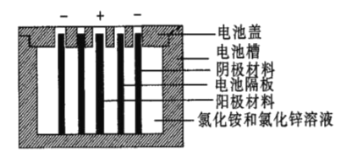
A.放电时,外电路每通过0.1NA个电子时,锌片的质量减少3.25g
B.充电时,聚苯胺电极的电势低于锌片的电势
C.放电时,混合液中的Cl-向负极移动
D.充电时,聚苯胺电极接电源的正极,发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用软锰矿浆烟气脱硫吸收液制取电解锰,并利用阳极液制备高纯碳酸锰、回收硫酸铵的工艺流程如下(软锰矿的主要成分是MnO2,还含有硅、铁、铝的氧化物和少量重金属化合物等杂质):
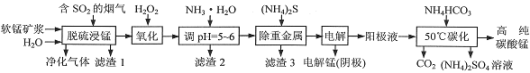
(1)一定温度下,“脱硫浸锰”主要产物为MnSO4,该反应的化学方程式为__。
(2)“滤渣2”中主要成分的化学式为__。
(3)“除重金属”时使用(NH4)2S而不使用Na2S的原因是__。
(4)“电解”时用惰性电极,阳极的电极反应式为__。
(5)“50℃碳化”得到高纯碳酸锰,反应的离子方程式为___。“50℃碳化”时加入过量NH4HCO3,可能的原因是__(写两种)。
(6)已知:25℃时,Kw=1.0×10-14,Ka(NH3·H2O)=1.75×10-5。在(NH4)2SO4溶液中,存在如下平衡:NH4++H2O![]() NH3·H2O+H+,则该反应的平衡常数为__。
NH3·H2O+H+,则该反应的平衡常数为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列图示所得结论正确的是
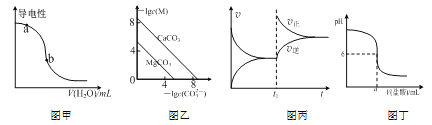
A.图甲表示一定温度下,CH3COOH稀溶液加水时溶液的导电性变化,则pH(a)>pH(b)
B.图乙表示一定温度下,MCO3(M:Mg2+、Ca2+)的沉淀溶解平衡曲线,则Ksp(MgCO3)<Ksp(CaCO3)
C.图丙表示一定温度下,可逆反应N2(g)+3H2(g) ![]() 2NH3(g)正逆反应速率随时间变化的曲线,t1时改变的条件可能是分离出NH3
2NH3(g)正逆反应速率随时间变化的曲线,t1时改变的条件可能是分离出NH3
D.图丁表示常温下将0.1 mol·L-1盐酸溶液滴加到a mL0.1 mol·L-1BOH溶液中,所得溶液pH随所加入盐酸溶液体积的变化图,则BOH为弱碱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com